摂食関連メラニン凝集ホルモン受容体 (MCHR1) のGi/o選択的活性に関与するアミノ酸残基の特定
Tweet執筆者情報
執筆者:濱本明恵、小林勇喜、斎藤祐見子
執筆者所属:広島大学大学院 総合科学研究科
原著論文:Identification of amino acids that are selectively involved in Gi/o activation by rat melanin-concentrating hormone receptor 1. (Cellular Signaling 27, 818-827, 2015.)
更新日:2015年5月13日
概要
G蛋白質共役型受容体は多くの生理機能に関与し、創薬における主要な標的の1つである。しかし、受容体がどのように特定のG蛋白質を「選択」するかは不明の点が多い。我々は、摂食関連メラニン凝集ホルモン受容体MCHR1のG蛋白質選択性が生物種間で異なるという特性を利用し、G蛋白質Gi/o選択的共役部位を特定した。MCHR1の場合、1つのアミノ酸ではなく、複数のアミノ酸が構成する特異な立体構造がGi/o認識に必要と考えられる。
背景
メラニン凝集ホルモン(MCH)は哺乳類の視床下部外側野で産生され、脳内に広範囲に投射される神経ペプチドである[1]。その受容体MCHR1はG蛋白質共役型受容体(GPCR)に属する[2,3]。GPCR は細胞外ドメインにリガンドが結合すると立体構造が変化し、細胞内でG 蛋白質と共役することで情報伝達を行う。遺伝子改変動物や選択的アンタゴニストを用いた行動薬理実験から、MCH-MCHR1 系は摂食行動やエネルギー代謝に加えて、情動に重要な役割を担うことが報告された[4,5]。そのため、MCHR1は肥満やうつ、不安に対する治療の創薬ターゲットの1つと考えられている。これまで我々は哺乳類MCHR1の緻密な構造活性相関を解析し、さらにMCHR1結合蛋白質を同定することにより、受容体fine-tuning機構を明らかにしてきた。
G蛋白質は複数のファミリー(Gs、Gi/o、Gq、G12/13)に分類される。GPCRの中には複数種のG蛋白質を活性化するものがあり、共役したG蛋白質の種類によって下流の情報伝達系が全く異なることから、この違いが多様な生理機能を制御する可能性がある。しかし、G蛋白質選択性を決定する受容体側のアミノ酸残基の予測は難しく、特に複数のG蛋白質が共役するGPCRにおいて、それらの選択的共役に重要なアミノ酸残基が報告された例は非常に少ない。哺乳類MCHR1は2種類のG蛋白質(Gi/o及びGq)と共役しうるが[2,3]、受容体のどのドメインが両者との選択的共役に関与するかわかっていない。そこで、本研究では種間の生化学的な差を利用した変異体設計を行い、哺乳類MCHR1のGi/o選択的共役部位の特定を目指した。
アミノ酸置換体の作製
キンギョやカレイのMCHR1はGqと共役するが[6]、哺乳類MCHR1はGi/o、Gqと共役する[2,3]。GPCRのG蛋白質選択性がこのように種間で大きく異なることは珍しい。そこで我々はこの特徴を活用し、ラット MCHR1の特定のアミノ酸残基をキンギョの相同配列に置換することで、Gi/o共役能が消失すると考えた。まず、Flagタグを付加したラットMCHR1(FMCHR1)を鋳型に、細胞内第1ループ領域の7アミノ酸残基(i1_7sub)、第2ループ領域の6アミノ酸残基(i2_6sub)、第3ループ領域及び第5膜貫通領域の6アミノ酸残基(i3_6sub)をそれぞれ置換した置換体を作製した(図1A)。置換体をヒト胎児腎臓(HEK293T)細胞へ一過性発現させ、ウエスタンブロットとFACSにより各受容体の発現量を調べた。FMCHR1は糖鎖付加の異なる複数のバンドが検出されたが、いずれの置換体も同様のパターンを示した(図1B)。さらに各置換体は主に細胞膜上に発現することを確認し(図1C)、FMCHR1と同程度のリガンド結合能を有することが示された。
細胞内Ca2+濃度測定(Flexstation)によるGi/o及びGq活性の評価
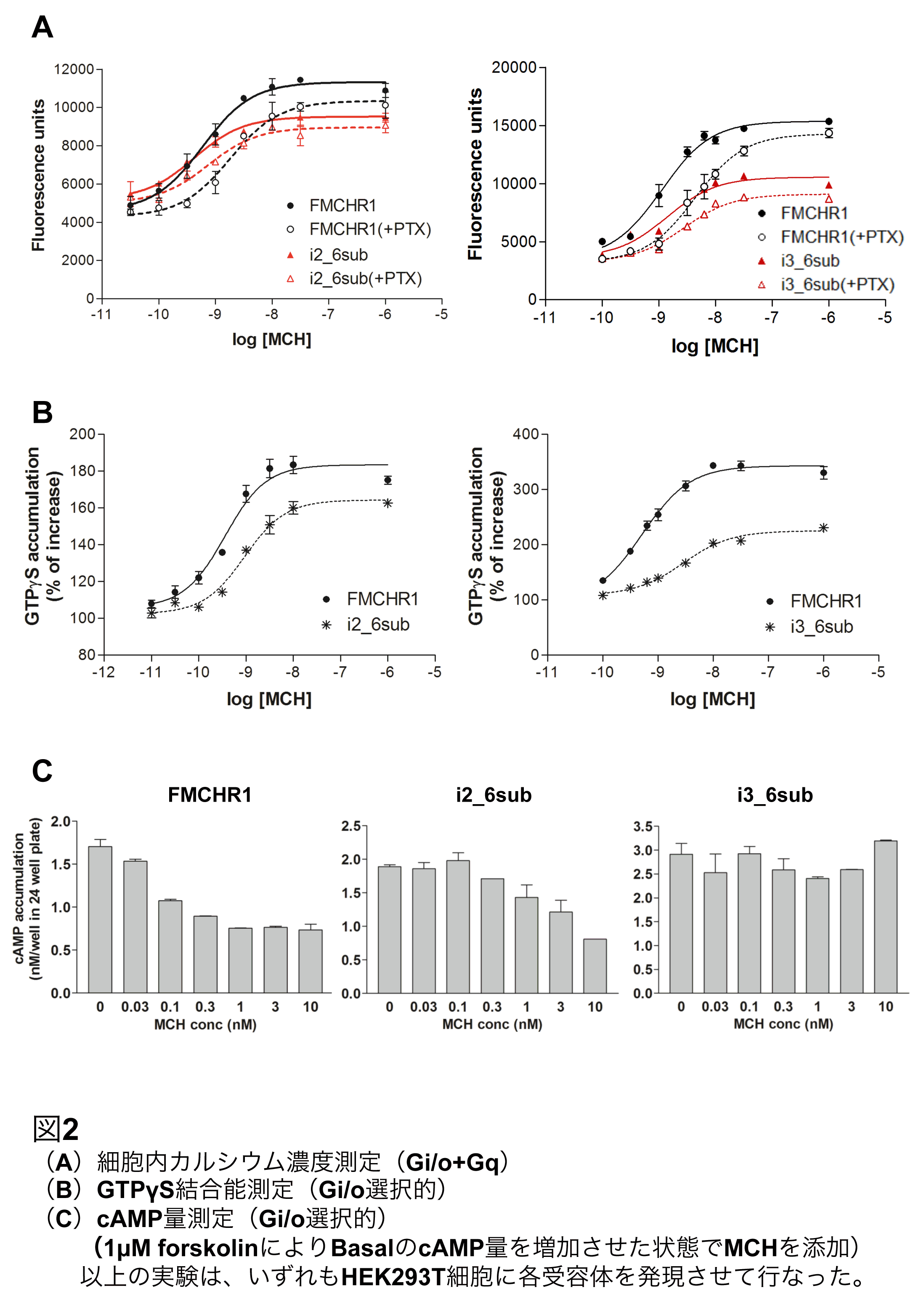
哺乳類MCHR1発現細胞にMCHを添加すると、Gi/o及びGqを介して細胞内Ca2+濃度が上昇する。そこで、Gi/oを特異的に不活性化する百日咳毒素(PTX)を用いて置換体のGi/o活性を評価した。FMCHR1にPTXを添加すると、Gi/o活性が消失するために濃度反応曲線は右側にシフトし、EC50は3.2倍上昇した(図2A)。i1_7subはFMCHR1と同様の反応を示した。一方、i2_6subとi3_6subはPTXによる影響は少なく、EC50はそれぞれ1.3倍、1.7倍と、FMCHR1と比べて有意差は認められなかった。即ち、細胞内Ca2+濃度測定においてi2_6subとi3_6subはPTX感受性低下を示し、Gi/o活性低下が示唆された。また、置換体のGq活性を評価するため、PTXを処理した状態(=Gq活性選択的)におけるEC50を比較した。その結果、いずれの置換体もFMCHR1と比べて有意差は認められなかった。以上より、i2_6subとi3_6subはGq活性に影響を与えることなく、Gi/o活性が低下していることが示された。
Gi/o活性に重要なアミノ酸残基の探索
i2_6sub及びi3_6subにおいてGi/o活性に重要なアミノ酸残基を特定するため、置換箇所を様々に組み合わせた置換体を作製した。それらについて細胞内Ca2+濃度測定によりPTX感受性を評価したところ、アミノ酸1−2残基だけでなく、4残基を同時に置換してもPTX感受性に変化は見られなかった。従って、複数のアミノ酸を同時に置換することがGi/o活性低下に必要であると推測される。
様々なアッセイ系によるGi/o活性の評価
置換体のGi/o活性を詳細に調べるため、Gi/o活性選択的なGTPγS結合能測定を実施した。i2_6subとi3_6subはFMCHR1と比べてEC50が上昇、最大反応が有意に低下し、GTPγS結合能の低下が示された(図2B)。さらにGi/o特異的なcAMP量測定において、i2_6subはFMCHR1よりもEC50が40倍増加し、i3_6subはMCHを添加してもcAMP量の減少を示さなかった(図2C)。最後に、古典的なセカンドメッセンジャー測定ではなく、統合的な細胞内応答を評価するDynamic mass redistribution(DMR)アッセイを行った。この手法により、シグナル伝達が生じた場合の細胞形態及び分子密度の変化を測定することができ、実際、共役したG蛋白質の種類に応じて、特異的なDMR応答が生じることが知られている[7]。この特殊なアッセイ系においても、i2_6subとi3_6subのGi/o活性低下を支持する結果が得られた。
考察と結論
GPCR結晶構造解析により、その構造解明は大きく進展している。それにも関わらず、G蛋白質選択性を決定する構造についての知見は乏しい。本研究ではAlaスキャンニングなどのコンベンショナルな方法ではなく、(i)種間におけるMCHR1のG蛋白質選択性の違い、(ii)noncanonicalな統合的シグナル測定を用いることにより、Gi/o選択的共役に重要なアミノ酸残基の特定を行った。その結果、独立した2箇所、つまり、細胞内第2ループ領域内の6アミノ酸残基、細胞内第3ループ領域及び第5膜貫通領域内の6アミノ酸残基がそれぞれGi/o活性に重要であることを見出した。一般的にGPCRの細胞内第2、第3ループ領域はアミノ酸数・配列共にバリエーションに富んでおり、この多様性がG蛋白質選択性を決定すると考えられている[8]。しかし、Gi/o選択的活性における細胞内第2ループ領域や第5膜貫通領域の重要性を指摘した報告は今回が初である。細胞内第3ループ領域においても、本研究で同定した6アミノ酸残基はすべてGi/o選択的活性部位としては新規となる。
ロイコトリエンB4受容体やα2Aアドレナリン受容体では、タンデムな数アミノ酸の置換によりGi/o活性低下を示した。一方、本研究では不連続な6アミノ酸残基を同時に置換して初めてGi/o活性が低下した。この結果は、複数のアミノ酸が構成する立体構造がGi/o選択的活性に重要であることを意味する。MCHR1の3次元相同モデルでは、細胞内第2、第3ループ領域は他のループと空間的に相互作用せず、G蛋白質の接近が容易であることが予測されている[9,10]。今後は、不連続な6アミノ酸残基を変異させた結果、大きく変わりうる構造を予測し、MCHR1-Gi/o相互作用の3次元相同モデルを作製することが必要であろう。さらに、本研究で見出されたGq活性選択的な置換体のノックインマウスを作出し、行動解析を行うことで、哺乳類MCHR1に共役するGi/oとGqがそれぞれ担うシグナル伝達の詳細や生理機能の解明が可能となるかもしれない。本研究で初めて取り入れた2つの手法とその成果は、他のGPCRにおけるG蛋白質選択性の仕組み解明に役立つことが期待される。
参考文献
1. Bittencourt et al. J. Comp. Neurol. 319 (1992) 218-245.
2. Chambers et al. Nature 400 (1999) 261-265.
3. Saito et al. Nature 400 (1999) 265-269.
4. Chen et al. Endocrinology 143 (2002) 2469-2477.
5. Borowsky et al. Nat. Med. 8 (2002) 825-830.
6. Hamamoto et al. Reg. Pept. 169 (2011) 6-12.
7. Schroder et al. Nat. Biotech. 28 (2010) 943-949.
8. Moreira. Biochim. Biophys. Acta. 1840 (2014) 16-33.
9. Saito et al. Endocrinology 146 (2005) 3452-3462.
10. Nagata et al. Gen. Comp. Endocrinol. 188 (2013) 159-165.