細胞内機構とシナプス機構のハイブリッドによる安定なin vivo様の持続性発火の実現
Tweet執筆者情報
執筆者:アーチュアー・ヨケム、吉田基治
執筆者所属:Faculty of Psychology, Mercator Research Group―Structure of Memory, Ruhr-University Bochum, Bochum, Germany(研究室のWebサイト)
原著論文:A robust in vivo-like persistent firing supported by a hybrid of intracellular and synaptic mechanisms. (PLoS ONE 10:e0123799, 2015)
更新日:2015年6月10日
概要
短時間の情報の維持は、脳内でニューロンが持続的に発火することによってなされていると考えられている。一般的に、持続性の発火は複数のニューロン間のシナプス結合によって維持されると考えられてきた。一方で、近年の研究により、ニューロン自身がシナプスに頼ることなく持続性発火を維持できることが明らかになってきた。本研究では、この2つの持続性発火維持機構が存在することによる優位性をコンピュータシミュレーションを用いて調べた。
はじめに
短時間(200 ms - 30 s)の記憶保持が必要な場合、前頭前皮質や内側側頭葉においてニューロンの持続性発火(persistent firing)が見られる[1]。持続性発火は周波数が3-50 Hzの連続する発火で、感覚入力などの入力情報によって始まり、この入力が終わった後も記憶保持が必要な期間続く。記憶保持が必要なタスクでは、特定のニューロンの持続性発火が情報の保持を担っていると考えられている。しかし、入力が終わった後の持続性発火を維持するメカニズムについては不明な点が多い。
一般的に、持続性発火はニューロン間の反回性のシナプス結合によって維持されると考えられてきた[2]。反回性のシナプス結合とは、複数のニューロンの間を双方向に結ぶシナプス結合である。反回性のシナプス結合を持つ神経回路では、あるニューロンの発火が他のニューロンを発火させ、さらにその発火が元のニューロンを発火させるという具合に、複数のニューロンが互いを興奮し続けることによって持続性発火の維持が理論上可能である。しかし、反回性のシナプス結合による持続性発火は、発火過多、あるいは過少という状況に陥りやすく、安定性に欠けることが知られている[3]。
一方で、前頭前皮質や内側側頭葉のニューロンは、in vitro 実験で細胞単体が持続性発火を維持できることが示唆されている[4, 5]。近年、著者らは内側側頭葉の海馬という記憶の形成に重要な部位でも、ニューロン単体が持続発火を維持できることを示した[6, 7]。中でも海馬CA3という、反回性のシナプス結合が持続性発火を保持できると考えられてきた領域において、calcium activated non-selective cationic(CAN)電流というニューロン内の膜電流によって、シナプス結合がなくても持続性発火が維持されることを示した[7]。従って、脳には持続性発火を維持するメカニズムとして、反回性のシナプス結合とCAN電流の両方が存在する可能性がある。しかし、この2つのメカニズムが共存することによる優位性はほとんど調べられていない。本研究では、反回性シナプスとニューロン単体のメカニズムが共存することによる優位性を、in vitro 実験に基づいたコンピューターシミュレーションを用いて調べた。
結果
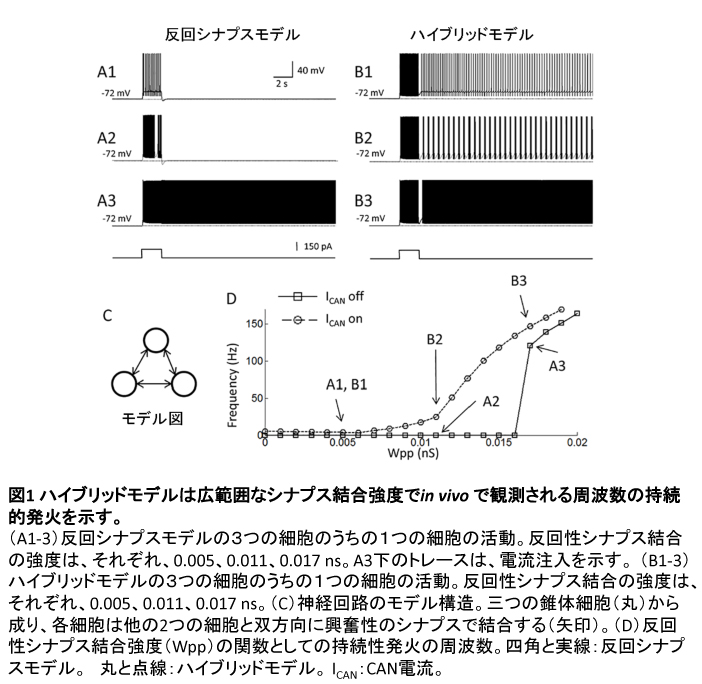
コンピューターシミュレーションに用いた神経回路は3つの細胞から構成され、各細胞は反回性のシナプス結合によって他の2つの細胞と結合している(図1C)。初めに、反回性のシナプス結合の強度増加に伴って持続性発火の周波数がどのように変化するかを、反回性のシナプス結合のみを持つモデル(反回シナプスモデル)と、反回性のシナプス結合とCAN電流の両方を持つモデル(ハイブリッドモデル)とで比較した(図1 A, B)。
図1 A1は、反回性シナプス結合が弱い(0.005 nS)場合の反回シナプスモデルにおいて、3つの細胞のうちの1つの細胞の応答を示している(他の2細胞の活動も同じ)。シミュレーション開始後、全ての細胞の静止膜電位は -72 mV で安定している。海馬が持続的発火によって維持すべき情報は、2秒間の興奮性の入力として全ての細胞モデルに注入される。この2秒間の入力によって細胞が発火しているのがわかる(図1 A1)。しかし、入力終了後に細胞の膜電位は静止膜電位に戻り、持続性発火による情報保持はできない。これは、反回性シナプス結合が弱い(0.005 nS)場合、ニューロン同士が反回性シナプスを介して互いを興奮しあうことで持続性発火を維持することが不可能であることを示している。そこで、反回性シナプス結合強度を0.011、0.017 nSと徐々に強くした(図1 A2, A3)。反回性シナプス結合強度が0.017 nSに強化された場合に、2秒間の入力終了後もニューロンが発火し続けている。これが持続性発火である。興味深いことに、この反回シナプスモデルの示す持続性発火の周波数は120.4 Hz であり、in vivo で観察される持続性発火の周波数(3-50 Hz)の範囲外である。また、反回性シナプス結合強度が0.017 nS未満の場合には持続性発火が起きない(図1 D)。つまり、単純な反回シナプスモデルはin vivo で観測されるような周波数の持続性発火を再現できない。
次に、ハイブリッドモデルを用いて同様のシミュレーションを行った(図1 B)。ハイブリッドモデルでは、反回性シナプス結合が弱い(0.005 nS)場合でも持続性発火が観測される(図1 B1)。これは、CAN電流によってニューロン単体が持続性発火を維持できることによる。反回性シナプス結合強度を0.011、0.017 nSと徐々に強くすると、持続性発火の周波数が徐々に高くなった。持続性発火の周波数をみると、in vivo で観測されるような周波数帯域の持続性発火が、反回性シナプス結合強度が0から0.011 nSの間で再現されている(図1 D)。すなわち、ハイブリッドモデルではそれぞれの細胞にCAN電流があるので、in vivoで観測されるような比較的低い周波数帯の持続性発火が再現できる。
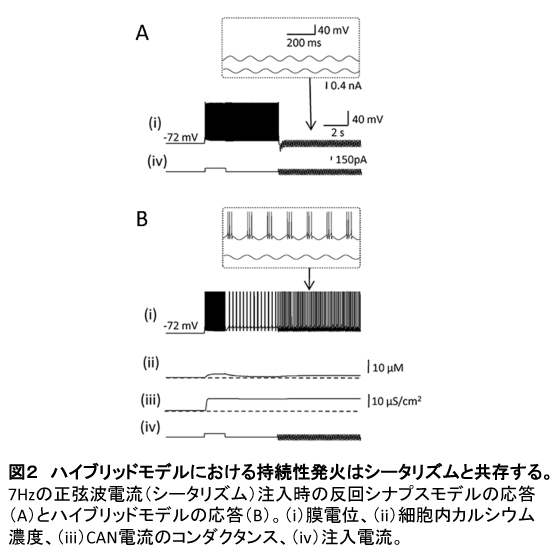
海馬を含む内側側頭葉では、シータリズムと呼ばれる約6-10 Hzの脳波が観測される[8]。シータリズムは記憶の形成に深く関わると考えられており、持続性発火が観測される、短時間の記憶保持が必要なタスクでも観測される[9]。しかし、シータリズムが持続性発火に与える影響はほとんど調べられていない。そこで、反回シナプスモデルとハイブリッドモデルにおいて、持続性発火とシータリズムの共存について調べた。
シミュレーションに用いた神経回路は図1 Cと同じである。図1の場合と同様に、2秒間の入力によって全ての細胞で持続性発火が始まる。シータリズムはその5秒後に7 Hzの正弦波として全ての細胞に注入される。図2 Aは、反回シナプスモデルでシータリズムの振幅が0.13 nAの場合の1つの細胞の活動を示す。シータリズムが始まってまもなく持続性発火が停止しているのがわかる。これは、シータリズムの谷の部分で細胞が過分極し、発火が抑制されることによる。反回シナプスモデルでは、短時間であるが、シータの谷部分で全ての細胞の発火が止まるとシナプスを介した相互興奮が起こらず、シータリズムの谷が終わっても持続性発火は再開しない。
一方で、ハイブリッドモデルではシータリズムが始まってからも持続性発火が続く(図2B)。右上の拡大図でわかるように、持続性発火は反回シナプスモデルと同様にシータの谷で一旦停止する。しかし、CAN電流の変化は遅く、シータリズムの谷部分での発火の欠如によってCAN電流が抑制されることはない(図2B (iii))。従って、シータリズムの谷が終わるとCAN電流によって発火が再開する。この結果は、CAN電流の存在が持続性発火とシータリズムとの共存を可能にすることを示唆している。
考察
本研究では、ニューロン単体がCAN 電流によって持続発火を示す機構を持つ場合に、脳の神経回路網レベルでの持続性発火にどのような優位性があるかを調べることを目的とし、コンピューターシミュレーションを行った。その結果、神経回路にCAN 電流が存在することによってin vivo で観測されるような低周波数の持続性発火が再現でき、さらに記憶の形成に関わるシータリズムと持続性発火の共存が可能になることがわかった。これらの結果は、CAN電流が単に持続性発火を維持できる2つ目の機構を提供するだけでなく、in vivo での持続性発火の維持に不可欠である可能性を示唆している。
参考文献
1. Hampson RE et al. Proc Natl Acad Sci USA (2004) 101:3184-3189.
2. Marr D. Phiols Trans R Soc Lond B Biol Sci (1971) 23-81.
3. Arnoid DB and Robinson DA. Exp Brain Res (1997) 113:57-74.
4. Reboreda A et al. Adv Exp Med Biol (2011) 704:595-613.
5. Yoshida M et al. Front Neural Circuits (2012) 6:10. doi:10.3389/fncir.2012.00010.
6. Knauer B et al. Hippocampus (2013) 23:820-831.
7. Jochems A and Yoshida M. Eur J Neurosci (2013) 38:2250-2259.
8. Buzsaki G. Neuron (2002) 33:325-340.
9. Griffin AL et al. Behav Neurosci (2004) 118:403-411.