Rbとp53の二重不活性化により、マウス甲状腺C細胞および線維芽細胞は高度な未分化性を獲得する
Tweet執筆者情報
執筆者:北嶋俊輔1,2、河野晋1、高橋智聡1
執筆者所属:1.金沢大学 がん進展制御研究所 腫瘍分子生物学、2.Harvard Medical School, Dana-Farber Cancer Institute, Medical Oncology
原著論文:Undifferentiated state induced by Rb-p53 double inactivation in mouse thyroid neuroendocrine cells and embryonic fibroblasts. (Stem Cells 33:1657-1669, 2015)
更新日:2015年6月17日
概要
Retinoblastoma(RB)遺伝子の異常は、発がん過程より、むしろがんの悪性進展過程においてより頻繁に観察される。RB不活性化がDNA損傷に応答したp53経路の活性化によるがん抑制シグナルを誘導するため、RB単独の異常は少ない。私達は、Rbおよびp53経路関連遺伝子の複合欠損マウスを作製し、p53 欠損背景におけるRb追加欠損が高い幹細胞様活性を誘導することを明らかにした。
はじめに
代表的ながん抑制遺伝子であるRetinoblastoma(RB)の遺伝子産物は、細胞周期におけるG1/S期の進行を制御する。RAS経路の活性化やp16の不活性化等に起因するRBの過剰リン酸化は、非常に多くのヒトがん細胞で観察される。しかしRB遺伝子自身の変異や欠失は、網膜芽細胞腫や肺小細胞がんなど一部の例を除くと、発がん過程ではなく悪性進展過程に集中して観察され、薬剤耐性獲得等との相関が報告されている(1.2.3)。これらの現象は、RBによる細胞周期の制御だけでは十分に説明がつかない。そこで本研究では、Rb不活性化による細胞周期への影響を極力排除したin vivoおよびin vitroモデルを作製することによって、がん悪性化を制御するRbの新規機能を解明することを目的とした。
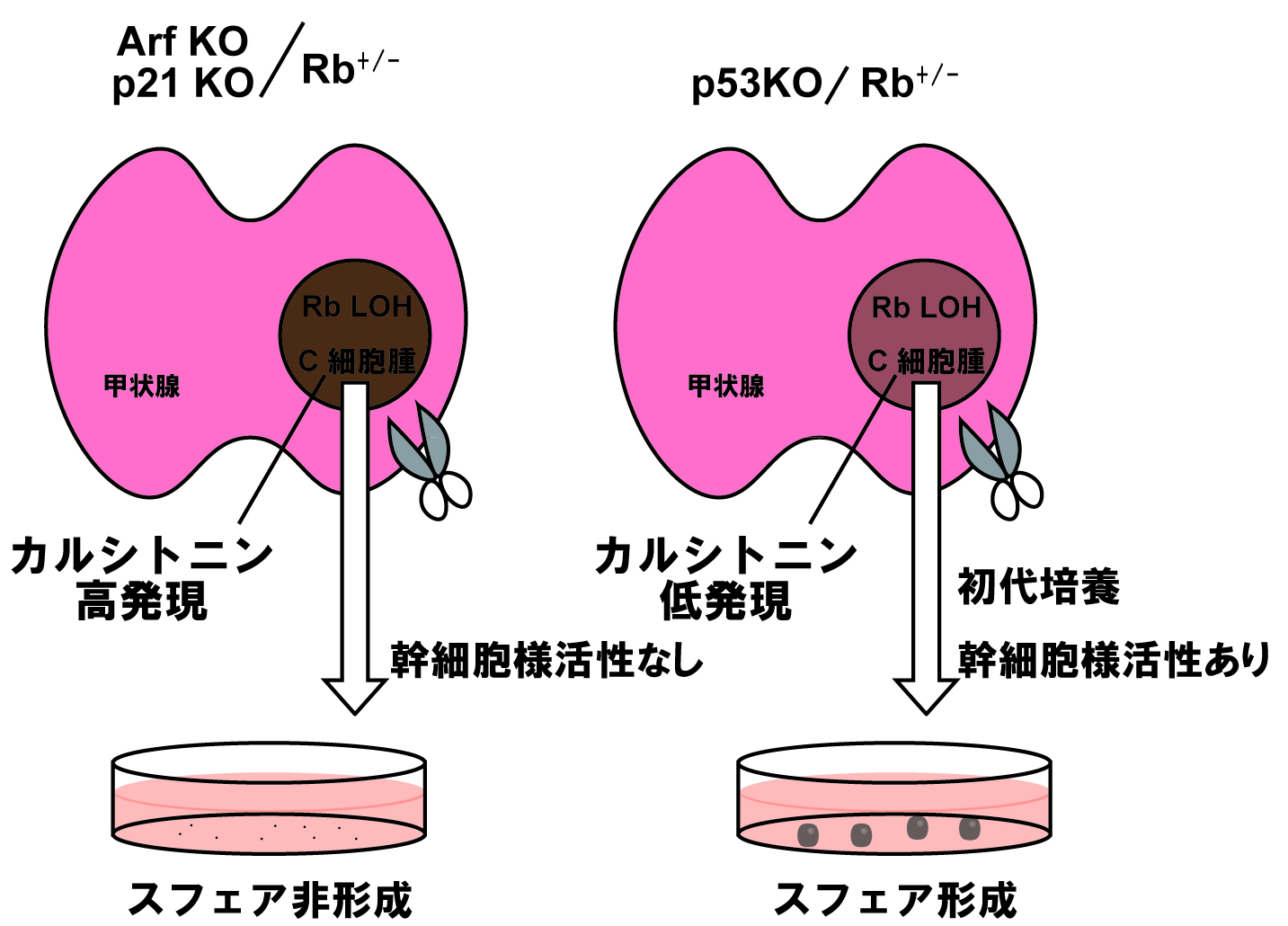
p53欠損型Rbへテロマウスは分化度の低い甲状腺腫瘍を生じる
Rbへテロ型マウスは、甲状腺カルシトニン産生細胞(C細胞)特異的にRb遺伝子の正常片側アレルの喪失(Loss of Heterozygosity (LOH))を生じる(4)。甲状腺C細胞におけるRb遺伝子単独の不活性化は、DNA傷害の増加に伴いp53経路を活性化し、がん化よりもむしろ細胞老化を誘導する(5)。そこでまず、3 つのp53経路遺伝子、p19 (Arf)、p53、p21をそれぞれ欠損したRbへテロマウスを作製し、甲状腺の解析を行ったところ、全ての個体において1年以内に甲状腺悪性腫瘍の形成が観察された。次に免疫染色により、腫瘍の増殖能や分化度について詳細な解析を行ったところ、p19、p53、p21欠損型のいずれの腫瘍組織も同程度の増殖マーカー(Ki67)陽性率を示したが、p53 欠損型においてのみ、C細胞分化マーカーであるカルシトニンの発現が非常に低い未分化腫瘍を発症した。そこで、この腫瘍から初代培養細胞を樹立し、培養皿上でその特性を詳細に解析した。その結果、p53欠損マウス由来の細胞株では、その他の遺伝子型の細胞株と比較してカルシトニンの低発現が認められることに加えて、継続的に培養可能なスフェアを形成する能力が有為に高かった。また、EGF、FGFを含む無血清培地を用いた3次元培養法により、一般的に自己複製能、幹細胞能の指標として用いられるPou5f1、Sox2などの胚性遺伝子を高発現していることがわかった。これらの結果から、p53 欠損背景におけるRb追加欠損は幹細胞様活性を誘導するという仮説を立て、次に線維芽細胞(MEF)を用いてこの仮説を検証した。
マウス線維芽細胞は、Rbとp53の二重不活性化により腫瘍形成能を伴わずに幹細胞様活性を獲得する
始めにp53欠損型MEFとRb/p53二重欠損型MEFの解析を行った。通常、正常な細胞周期制御機構を持つ野生型MEFを非常に薄い濃度で培養皿上に播種すると、細胞老化が誘導され増殖が停止するが、p53欠損型およびRb/p53二重欠損型MEFは、単一の細胞からでもコロニーを形成した。BrdU染色や3T3プロトコル等により増殖能を比較すると、p53欠損型MEFとRb/p53二重欠損型MEFの間に差はほとんど観察されなかったが、両者は野生型MEFやRb欠損型MEFと比べて著しく速い増殖速度を示した。このように2次元培養条件下では、p53欠損型MEFとRb/p53二重欠損型MEFは、ほぼ同等の高い増殖能を示すにも関わらず、3次元培養条件下においてはRb/p53二重欠損型MEFのみが胚性遺伝子を高発現し、継代可能なスフェアを形成した。さらに、p19欠損型MEFおよびp21欠損型MEFにおいてRbをノックダウンした場合には、スフェア形成能が誘導されず、p53欠損型MEFにおいてRbをノックダウンした場合のみ、スフェア形成能が誘導された。以上の結果から、p53 欠損背景におけるRb追加欠損により幹細胞様活性が誘導されるという現象が、甲状腺腫瘍細胞のみならずMEFにおいても観察され、細胞種によらない一般的な現象であることが示唆された。また、Rb/p53二重欠損型MEFおよびRbノックダウンp53欠損型MEFは免疫不全マウスに対して腫瘍形成能を示さないことから、Rbとp53の二重不活性化による幹細胞様活性の獲得は、正常細胞からがん細胞への形質転換とは独立した現象であることが示唆された。
RN6を使ったスクリーニング
Rb欠損型MEFはN-Rasを追加欠損することにより、容易に不死化する(4)。Rb/N-Ras二重欠損型MEFから、親株よりもさらに増殖の早いRN6細胞をクローニングした。RN6細胞はp53コドン278に変異を有しており、DNA結合ドメインのアミノ酸配列がアスパラギンからバリンへ置換していた。なお、RN6由来変異p53を発現させた野生型MEFは、単一の細胞からコロニーを形成した。また、RN6細胞は高いスフェア形成能およびヌードマウスへの造腫瘍能をもつが、Rb再構成によりこれらは抑制された。加えて、Rb過剰発現により、スフェアにおけるPou5f1とSox2の発現が低下した。その一方で、BrdU 染色等により増殖能を比較しても、Rb再構成による差は認められなかった。これらの結果から不死化MEFにおいて、Rbの不活性化は細胞周期制御機構に依存せずに、腫瘍原性を伴う幹細胞様活性の誘導に寄与することがわかった。
次に、Rb欠損により誘導される幹細胞様活性の維持に必要なパスウェイを明らかにするために、RN6細胞を用いた96ウェルベースのスフェアアッセイ系を構築した。作用分子が既知の化合物を複数含むFDA承認薬ライブラリーのスクリーニングを行い、同一標的の陽性化合物の占有率からスフェア形成に寄与する分子の確からしさを評価した。
その結果、従来の化学療法剤を除く6カテゴリの化合物がスフェア形成を抑制した。内訳は、ドパミンD2受容体アンタゴニスト(D2RA)、カルシウムチャネル遮断薬、アゾール系抗真菌薬、hydroxymethylglutaryl-CoA還元酵素阻害剤、ヒスタミンH1遮断薬、レチノイン酸受容体(RAR)アゴニストである。D2RA、RARアゴニストはがん幹細胞に抑制的に作用することが報告されており(6,7)、本スクリーニングで用いた細胞系ががん幹細胞の挙動を反映するものであることを示唆している。
おわりに
ヒトがんで観察されるがん悪性進展過程におけるRB変異・欠失に着目し、p53 欠損背景モデルを解析に用いた。その利点として、以下の2点が挙げられる。
(1)Rb不活性化に伴う、がん抑制的に作用するフィードバック機構を排除することで、Rb不活性化によるがん悪性化への直接的な影響を際立たせることができる。
(2)p53欠損型細胞はRb野生型であるが、2次元培養下で非常に速い増殖速度を示し、すでに正常の細胞周期制御機構を有していない。そのため、Rb不活性化による細胞周期への影響が顕在化しにくく、新規機能の解明に適している。
本研究では、私達が新規構築した上記解析モデルを用いることにより、幹細胞性の制御という細胞周期制御以外のRbの新規機能を解明した。また、本モデルはRb不活性化によりがん幹細胞様細胞を誘導するin vitroがん幹細胞モデルとして、がん幹細胞の成立・維持機構を解明するための様々な研究に応用できると考えている。
参考文献
1. Bosco, EE. et al. The Journal of Clinical Investigation 117, 218-228, 2007
2. Burkhart, DL. and Sage, J. Nature Reviews Cancer 8, 671-682, 2008
3. Sharma, A. et al. The Journal of Clinical Investigation 120, 4478-4492, 2010
4. Williams, BO. et al. Nature Genetics 7, 480-484, 1994
5. Shamma, A. et al. Cancer Cell 15, 255-269, 2009
6. Sachlos E, et al. Cell 149, 1284-1297, 2012
7. Bhat-Nakshatri P, et al. Sci. Rep.3, 2530, 2013