in vitro及びin vivoにおける神経細胞の興奮毒性はカルパインによるドレブリン分解を誘導する
Tweet執筆者情報
執筆者:千村崇彦1、トーマス・ローニー2、吉田進昭1
執筆者所属:1. 東京大学 医科学研究所 システム疾患モデル研究センター 発生工学研究分野、2. 理化学研究所 脳科学総合研究センター 記憶持続シナプス分子研究チーム
原著論文:Calpain-Mediated Degradation of Drebrin by Excitotoxicity in vitro and in vivo. (PLoS ONE 10:e0125119, 2015)
更新日:2015年6月24日
(*2015年7月7日に改訂版を掲載)
概要
神経細胞の興奮毒性に伴う細胞死の過程において、f-アクチン結合・安定化タンパク質drebrin(ドレブリン)が、カルシウム依存性プロテーゼであるカルパインによって直接分解されることをin vivo、in vitroで示した。また、強制的なf-アクチンの安定化がドレブリンの分解効率に影響を与えることから、細胞死の過程でf-アクチンの消失をモニターするシステムの存在が示唆された。
背景
高齢者の認知症を引き起こす原因の1位がアルツハイマー病、2位が脳梗塞などの血管系疾患に由来する血管性認知症であり、いずれの疾患でも脳における神経細胞死が伴っている。グルタミン酸は神経細胞間の情報伝達を仲介する極めて重要な神経伝達物質であるが、グルタミン酸の量が過剰だと神経細胞の細胞死が誘導されることが知られており、これを興奮毒性と呼ぶ。注目すべきことに、脳梗塞などの急性の神経疾患だけでなく、アルツハイマー病などの慢性の神経疾患で認められる神経細胞死においても共通の原因として、興奮毒性の関与が示唆されている[1,2]。
認知症患者の脳ではアルツハイマー病の所見と同時に脳梗塞の病変が見つかることも多く、また両疾患の間には「高齢」以外にも「高血圧」や「高コレステロール血症」など複数のリスクファクターの共通性が指摘されており、近年「アルツハイマー病と脳梗塞(に伴う認知機能低下)は関連性がある」との考え方が注目されている。従って、興奮毒性による神経細胞死の分子メカニズムの理解は、多様な神経疾患の病態の理解と治療法の確立に必須である。さらに、実際にアルツハイマー病と脳梗塞において分子レベルで同じ異常が検出されるかどうかを明らかにすることは、両疾患の共通の分子基盤を理解する上で重要な知見となる。
アルツハイマー病では脳に老人斑と神経原繊維変化が認められるが、細胞骨格f-アクチンを安定化するドレブリンタンパク質の量が減少していることも報告されている[3-5]。ドレブリンは神経細胞のシナプスに局在し、神経の細胞骨格の制御やグルタミン酸受容体の活性制御に関わる、種間保存性の高い重要なタンパク質である[6,7]。しかし、アルツハイマー病患者の脳でドレブリンが減少するメカニズムは明らかになっておらず、ドレブリンの減少が脳梗塞でも起こっているかについては未解明のままだった。本論文では「ドレブリンの消失が興奮毒性によって引き起こされるのではないか?」との仮説を立て、検証を行うとともに消失の意味を探った。
結果
■ 神経の興奮毒性に伴うドレブリン分解とカルパインの関与
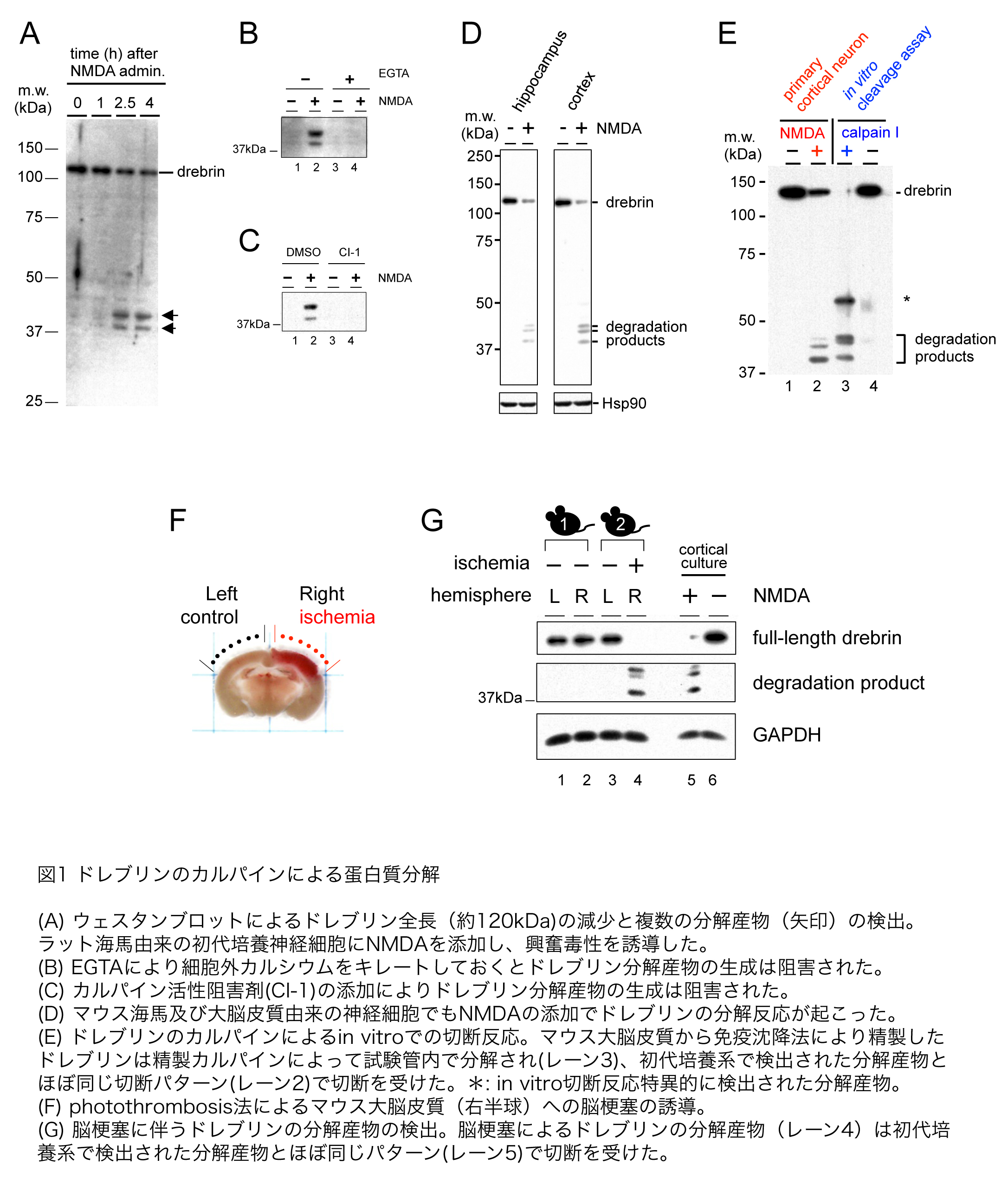
神経細胞に対する刺激条件を制御しやすい初代神経培養系を用いて、興奮毒性がドレブリンタンパク質の安定性に与える影響を検討した。興奮毒性は、NMDA(N-methyl-D-aspartate)型グルタミン酸受容体が主要な役割を果たしている。24時間後には神経細胞死が顕在化する過剰興奮刺激として、NMDAの最終濃度が30 microMになるようにラット海馬由来の初代培養神経細胞に添加し、一定時間培養した後のドレブリンの量をウェスタンブロット法により定量した。その結果、NMDA添加2.5時間後には全長約120 kDaのドレブリンの量が減少し、約40 kDaの領域に分解産物と思われる複数の断片が検出された(図1A)。
比較的早い時間スケールでタンパク質の減少が起こること、低分子量側に新たにバンドが検出されたことから、何らかのプロテアーゼによるタンパク質分解が起こっているものと考えられた。NMDA型グルタミン酸受容体は細胞外から細胞内にカルシウムを流入させるチャネルとして機能することから、カルシウム依存的なプロテアーゼであるカルパインの関与が予想された。実際、培地にカルシウムキレート剤であるEGTA(ethylene glycol tetraacetic acid)を添加し、細胞外から細胞内へのカルシウム流入を阻害すると、分解産物の産生も阻害された(図1B)。また、カルパイン活性阻害剤を添加した場合でも分解産物の生成が阻害された(図1C)ことから、カルパインがドレブリンを分解していることが示唆された。この分解反応はラットだけでなくマウスの海馬及び大脳皮質の初代培養神経細胞を用いても同様に検出された(図1D)。ただし、ラットの場合分解産物は40 kDa付近に2本、マウスの場合は3本検出された。おそらくラットの場合はマウスで検出されている3本のうちの高分子量側の2本が重なって1本に見えているものと推測している。
次に、カルパインが直接ドレブリンを分解しているかを検討した。マウス脳抽出液から免疫沈降法によりドレブリンを精製し、そこに精製カルパインを添加して一定時間インキュベートしたところ、ドレブリン全長の消失と、分解産物の生成が検出された(図1E)。このことから、ドレブリンが直接カルパインにより切断されることがわかった。
■ 脳梗塞に伴うドレブリン分解反応
ドレブリンの分解反応が生体における脳疾患モデルでも起こるかを検討した。脳梗塞による神経細胞死ではグルタミン酸による神経細胞の過剰興奮が神経細胞死の主たる要因と考えられている。そこで、マウス大脳皮質に人為的に脳梗塞を誘導し、ドレブリンの安定性をウェスタンブロットにより解析した。
脳梗塞の誘導はphotothrombosis法という、光反応性色素ローズベンガルを血流に乗せ、脳梗塞を誘導したい部位に光照射を行い、活性化されたローズベンガルによる血管傷害作用を利用した脳梗塞モデルを用いた(図1F)。脳梗塞誘導3時間後に梗塞部位からタンパク質を抽出し、ウェスタンブロット法によりドレブリンの量を調べたところ、予想どおりドレブリン全長の量が減少し、40 kDa付近に複数の分解産物が検出された(図1G)。このことから神経細胞の興奮毒性に伴うドレブリンの分解反応は、脳梗塞による傷害部位で実際に起こる反応であることが示された。
■ f-アクチンとドレブリンの分解の機能的な関連性
ドレブリンはf-アクチンを安定化する。我々はドレブリンの分解がf-アクチンにどのような影響を与えるのかを明らかにする目的で、まずラット海馬由来の初代神経培養系を用い、興奮毒性を示す神経細胞における全長ドレブリンとf-アクチンの存在量を細胞染色法により調べた(図2A-H)。その結果、NMDA添加によるドレブリン量の減少と共にf-アクチンも減少することが分かった。
次にf-アクチンの安定性がドレブリンの分解反応にどのような影響を与えるかを調べた(図2I-K)。f-アクチンを不安定化する薬剤であるlatrunculin A(Lat-A)を培養液に添加し、f-アクチンを消失させた上で、NMDAを添加し、ドレブリンの分解反応を調べた。その結果、Lat-A によるf-アクチン消失はドレブリンの分解反応に影響を与えないことがわかった。また、f-アクチン消失自体がドレブリンの分解反応を誘導することもなかった(図2I、レーン1)ので、「f-アクチンの消失とドレブリンの消失が同じ神経細胞内で認められる」という現象(図2E, F)は、f-アクチンの消失が引き金となってドレブリンが分解されたわけではないことを示している。
一方、jasplakinolideによりf-アクチンを強制的に安定化したところ、NMDA添加に伴うドレブリンの分解反応が促進されることがわかった(図2I、レーン5と6の比較)。このことは興奮毒性による神経細胞死に伴ってf-アクチンの消失が適切に進まないと、f-アクチン安定化タンパク質であるドレブリンをより早く分解させるようなフィードバック機構が存在することを強く示唆している。
考察
ドレブリンタンパク質のカルパインによる分解は、神経細胞の興奮毒性の分子的な指標(分子マーカー)となり得る。神経細胞死を伴う疾患においてドレブリンの分解産物が検出されるかどうかは、細胞死の分子機構を推定するうえで重要な指標となる。既にアルツハイマー病患者の脳ではドレブリンの量が減少していることが報告されており、アルツハイマー病ではカルパインが活性化されているとの報告も考え合わせると、カルパインによるタンパク質分解がドレブリン消失の主要な原因である可能性が強く示唆される。しかし、これまでに分解産物を検出した報告はない。おそらくウェスタンブロットで使用された抗体の種類の違いと思われる。アルツハイマー病患者脳における分解産物の検出は今後の課題である。本研究で得られた知見は様々な脳神経疾患の細胞死やその原因となる分子基盤を理解するうえで役立つものと期待される。
興奮毒性によりf-アクチンの消失が誘導され(図2A-H)、f-アクチンの消失が効率よく進まない時、f-アクチン安定化タンパク質の分解を加速させ、f-アクチンの消失を加速させるようなフィードバック応答の存在が示唆された(図2I-K)。もしf-アクチンの消失がそのような厳密な制御下に置かれる必要があるとするなら、興奮毒性による神経細胞死の後に脳で起こることと関連しているかもしれない。脳梗塞など興奮毒性が起こるような病的な状況では、様々な免疫系細胞が血管から脳の実質内に浸潤してくることが知られている。免疫系細胞にはf-アクチンを認識し、免疫応答を活性化させる受容体が存在することが近年明らかになってきた[8,9]。このことは免疫系細胞が病変部に到達したときに、そこにどの程度のf-アクチンが存在するか(あるいは存在しないか)によって病変部の細胞がどのような細胞死の過程を経たかを判定している可能性がある。今後の解析においてカルパインによる分解に対して抵抗性をもつドレブリン変異体を作成することができれば、f-アクチン消失に対するドレブリン分解反応の役割の解明と共に、神経細胞死と免疫系との関連性についても解明の糸口となることが期待される。そのためにも、ドレブリンを分解するカルパインの種類の特定と、カルパインによるドレブリン切断サイトの特定は優先度の高い課題であろう。
参考文献
1. Choi DW. Neuron 1:623-634, 1998
2. Kalia LV et al. Lancet Neurol 7:742-755, 2008
3. Ishikawa R et al. J Biol Chem 269:29928-29933, 1994
4. Asada H et al. J Neurosci Res 38:149-159, 1994
5. Harigaya Y et al. J Neurosci Res 43:87-92, 1996
6. Takahashi H et al. J Neurochem 97 Suppl 1:110-115, 2006
7. Kojima N et al. Neuroscience 165:138-150, 2010
8. Ahrens S et al. Immunity 36:635-645, 2012
9. Zhang JG et al. Immunity 36:646-657, 2012