安定型キメラFGF(FGFC)はヒト多能性幹細胞の培養においてbFGFを代替する
Tweet執筆者情報
執筆者:小沼泰子、伊藤弓弦
執筆者所属:産業技術総合研究所 創薬基盤研究部門(ホームページ)
原著論文:A Stable Chimeric Fibroblast Growth Factor (FGF) Can Successfully Replace Basic FGF in Human Pluripotent Stem Cell Culture. (PLoS ONE 10:e0118931, 2015)
更新日:2015年7月1日
概要
本研究では、ヒトFGF1とbFGF(FGF2)のドメインから構成されるキメラタンパク質であるFGFCが、従来から用いられているbFGFの代替品として、ヒト多能性幹細胞の維持培養に有効であることを明らかにした。FGFCは大腸菌等のバクテリアを用いたリコンビナントタンパク質発現系で生産でき、FGF1やbFGFよりも高い熱安定性とプロテアーゼ耐性を示すため、培養の安定化への貢献が期待される。
背景
FGF(Fibroblast Growth Factor)シグナルはMAPK(Mitogen-Activated Protein Kinase)/ERK(Extracellular Signal-Regulated Kinase)経路やPI3K(Phosphoinositol 3-Kinase)/AKT経路を介し、ヒトES細胞およびiPS細胞の未分化維持に働いている[1-4]。そのため多くのヒト多能性幹細胞培養法で、bFGFリコンビナントタンパク質が培地に必須な因子として添加される。しかしながら、培地中のbFGFタンパク質は安定性が低く、4時間で50%以上分解してしまうことが報告されており[5]、培地中のFGF濃度を維持するために、bFGFの定期的な添加供給が必要とされている。
本研究所では、以前にヒトFGF1とbFGFのキメラタンパク質であるFGFCを作製し、FGFCが大腸菌等のバクテリアを用いたリコンビナントタンパク質発現系で生産でき、FGF1やbFGFよりも高い熱安定性とプロテアーゼ耐性を示すことを報告した[6]。本研究では、このFGFCがヒト多能性幹細胞の維持培養に有効であるかどうかを検証した。
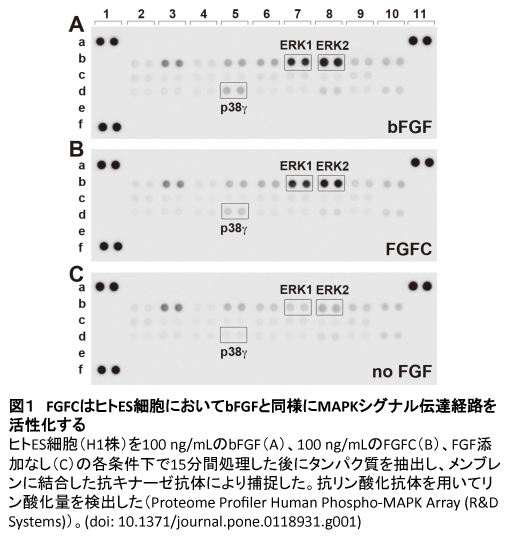
ヒト多能性幹細胞において、FGFCはbFGFと同様の細胞内シグナルを活性化する
以前の研究で、FGFCがFGF1と同様に7つのFGF受容体すべてを活性化できるのに対し、bFGFはいくつかのFGF受容体に対して特異的な活性化を示すことがわかった[6]。そこで始めにFGFCがヒトES細胞において、どのような細胞内シグナルを活性化するのかを調べた。Proteome Profiler Human Phospho-MAPK Arrayを用いて、ヒトES細胞でMAPKに関連した26キナーゼのリン酸化状態を解析した。その結果、FGF処理をしていない細胞と比較して、bFGFまたはFGFCで処理した細胞では、ERK1、ERK2、p38γが有意にリン酸化された(図1)。このことは、ヒトES細胞においてbFGFとFGFCは同様の細胞内シグナル伝達経路を活性化することを示している。
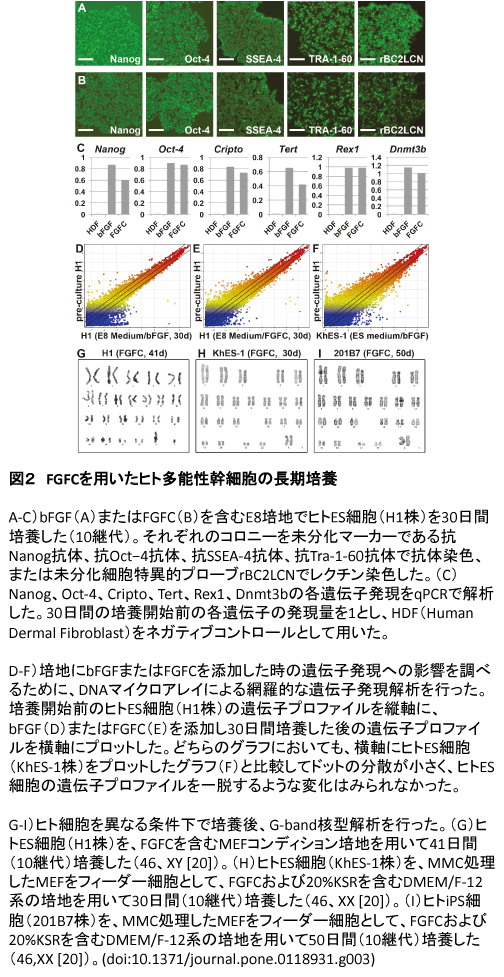
FGFCを用いたヒト多能性幹細胞の培養
ヒトES細胞およびiPS細胞を、bFGFの代わりにFGFCを同濃度含有する培地で維持培養し、培養後の性状を比較した(図2)。ヒトES細胞をFGFCを含む培地で30日間培養し、未分化マーカーの発現を抗体染色やqPCRで比較したところ、bFGFを含む培地で培養した場合と比べて差がなかった(図2A-C)。次に、bFGFまたはFGFCを含む培地での培養開始前と30日間培養後の細胞について、DNAマイクロアレイにより網羅的な遺伝子発現解析(全42,405プローブ)を行った結果、どちらの場合も遺伝子発現に大きな変化はなかった。
さらに、「ヒトES細胞(H1株)を、MEF(マウス胎児線維芽細胞)コンディション培地を用いて培養した場合」、「ヒトES細胞(KhES-1株)を、MEFをフィーダー細胞として20%KSRを含むDMEM/F-12系の培地を用いて培養した場合」、「ヒトiPS細胞(201B7株)を、MEFをフィーダー細胞として20%KSRを含むDMEM/F-12系の培地を用いて培養した場合」、「ヒトiPS細胞(253G1株)を、E8培地で培養した場合」、といった様々なヒト多能性幹細胞および培養系の組み合わせでbFGFをFGFCに代替して培養した後にも、網羅的な遺伝子発現解析を行い比較した。その結果、有意に発現に差があると考えられる発現量の差が2倍を示す遺伝子プローブのうち、すべての実験群で共通して変化を示すものはなかった。このことから、ヒト多能性幹細胞の培養にbFGFの替わりにFGFCを用いても特徴的な影響を与えないことがわかった。
また、これらの複数の培養方法によって培養したヒト多能性幹細胞について、G-band法による核型解析を行った結果、長期培養後の核型の変化は見られなかった(図2G-I)。さらに、胚様体形成によりin vitroで三胚葉への分化能を調べた結果、FGFCを用いて長期培養したヒトES細胞からも、神経(外胚葉)、筋肉(中胚葉)、肝臓(内胚葉)への分化が確認された。
これらのことから、FGFCは様々な細胞株および培養方法において、従来のbFGFの代替品としてヒト多能性幹細胞の維持培養に使用できることが明らかになった。今後、単にbFGFの代替品としてだけでなく、より安定性が重視される培養においてFGFCが力を発揮することを期待する。また、今回の結果では、FGFCとbFGFの受容体特異性の違いがヒト多能性細胞の維持培養に影響を与えなかったため、他のFGFシグナル要求性細胞(神経幹細胞等)の維持培養においても同様にbFGFを代替できる可能性がある。また、逆に両者の受容体特異性の違いを利用して、これまでbFGFを用いていた分化誘導系において、誘導効率の改善や分化方向の部分的な修正等に活用できるかもしれない。
参考文献
1. Vallier Let al.(2005) J Cell Sci. 118: 4495-4509.
2. Dvorak P et al. (2005) Stem Cells. 23: 1200-1211.
3. Li J et al. (2007) Differentiation. 75: 299-307.
4. Ding VM et al. (2010) J Cell Physiol. 225:417-428.
5. Lotz S, et al. (2013) PLoS One. 8: e56289.
6. Motomura K et al. (2008) Biochim Biophys Acta. 1780:1432-1440.