小胞体内カルシウムの減少に依存した筋分化制御機構
Tweet執筆者情報
執筆者:中西慶子、森島信裕
執筆者所属:国立研究開発法人 理化学研究所 小林脂質生物学研究室
原著論文:Transient Ca2+ depletion from the endoplasmic reticulum is critical for skeletal myoblast differentiation. (The FASEB Journal 29:2137-2149, 2015)
更新日:2015年7月22日
概要
マウス骨格筋の最終分化過程において、小胞体ストレスが一過的に生じ、これが分化の進行に必須であることを私たちは以前報告した。しかし、分化という生理的状況下において何が小胞体ストレスを引き起こしているのかは不明であった。本研究で私たちは小胞体内カルシウム枯渇によって誘導される特殊な小胞体膜構造を見出し、これを指標とすることで筋分化進行にとって必須である小胞体ストレス源が小胞体内カルシウム枯渇であることを突き止めた。
はじめに
骨格筋の最終分化過程は、筋芽細胞が多数融合して多核の筋管細胞になり、更に融合を繰り返しながら筋繊維細胞へと成熟していく過程(以下、これを筋分化過程と呼ぶ)である。筋分化過程で一部の筋芽細胞はアポトーシスを起こす。このアポトーシスが小胞体ストレスと呼ばれる細胞ストレスによって引き起こされること、小胞体ストレスは筋分化初期に一過的に生じること、更には生き残った細胞の分化においても小胞体ストレスシグナルが必要であることを私たちは明らかにした(1)。
細胞内小器官の一つである小胞体の役割は多岐にわたる。粗面小胞体で合成された膜タンパク質、分泌タンパク質はその内腔で立体構造形成、糖鎖修飾が行われ、滑面小胞体は薬物代謝、脂質合成等の場になっている。また小胞体は細胞の主要なカルシウム貯蔵の場であり、細胞内外の様々な刺激に応じてカルシウム放出を介してカルシウム結合タンパク質を制御している(2)。小胞体ストレスは小胞体内にミスフォールディングしたタンパク質が蓄積した状態と定義され、多量のタンパク質合成、遺伝子変異やウイルス感染、グルコース飢餓、小胞体内カルシウム低下等の様々な要因によって引き起こされる(3)。小胞体ストレスは一般的には病的な状態であり、細胞にとって有害なものである。これが正常な筋分化過程でどのように生じているのか、その手がかりを得るために私たちは小胞体膜構造に着目して解析を行った。
筋分化過程で小胞体膜由来の球状構造が一過的に出現する
筋分化に伴って筋芽細胞が筋管、筋繊維細胞へと変化すると同時に、細胞内では小胞体が筋収縮の際のカルシウム放出に適した形態、機能を持つ筋小胞体へと変化する(4)。私たちはこの筋分化に伴った小胞体の変化が小胞体ストレスの発生と何らかの関連があるのではないかと考え、筋分化時の小胞体の形態変化を経時的に観察した。
In vitro分化系で小胞体を観察するため、マウス筋芽細胞株C2C12細胞を増殖培地から分化培地に移すことにより筋分化誘導を行った。分化培地に移された筋芽細胞は約三日から一週間かけて多核の筋管細胞へ分化する。この間の小胞体を、小胞体膜特異的な蛍光標識試薬であるER Trackerを用いて可視化した。
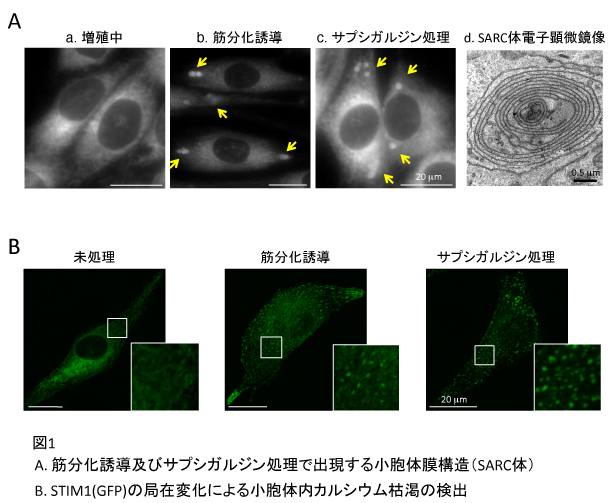
その結果、細胞融合が起こる直前の細胞においてER Trackerで標識される球状構造を発見した(図1A(a),(b))。この球状構造は分化の進行と共に小さくなり、細胞融合が進んで核数が10核程度になる頃にはほぼ消失する。類似した球状構造はマウス胎仔の筋発生時においても観察された。私たちは以前の研究で、筋繊維が作られつつある胎齢13.5日マウス胚の骨格筋組織において小胞体ストレスが発生することを報告している(1)。この組織中で、特に筋タンパク質の発現が起こり始める前の、より未分化な細胞においてER Tracker陽性の球状構造が多数観察された。培養系での経過と同様に分化が進んだ細胞中では球状構造は消失していた。
小胞体膜由来の球状構造は小胞体内カルシウム枯渇により誘導される
球状構造が小胞体ストレス依存的に形成されるかを検討するため、作用機序の異なる小胞体ストレス誘導薬剤を用いてC2C12細胞を処理した後、小胞体を観察した。用いた薬剤は、小胞体カルシウムATPアーゼ(小胞体内にカルシウムを取込む役割を担う)を阻害するサプシガルジン及びシクロピアゾン酸、小胞体内糖鎖修飾阻害剤であるツニカマイシン、小胞体ーゴルジ体間輸送阻害剤であるブレフェルディンAである。
小胞体ストレス応答によって発現が誘導される転写因子CCAAT/enhancer-binding protein homologous protein (CHOP)がどの薬剤処理でも検出されたのに対し、筋分化時と同様の球状構造は小胞体内カルシウム濃度低下を引き起こすサプシガルジン及びシクロピアゾン酸で処理した場合において特異的に形成された(図1A(c))。この結果はER Trackerで可視化される特殊な球状構造は小胞体ストレスに必ず伴って生じるのではなく、小胞体内カルシウム枯渇に依存した小胞体ストレスによって特異的に生じる構造であることを示唆している。サプシガルジンで処理したC2C12細胞の小胞体を経時的に観察した結果、処理後約2時間で生じた球状構造は8時間頃から小さくなり、36時間後にはほぼ消失した。このようにいったん形成された球状構造がやがて小さくなって消失する経過は筋分化過程で見られた現象と共通している。
C2C12細胞の筋分化誘導時及び小胞体内カルシウム枯渇誘導時に生じる小胞体膜由来の球状構造を透過電子顕微鏡により詳しく観察した結果、小胞体膜が何層にも積み重なった同心球構造をとることが明らかとなった(図1A(d))。この構造は非常に特徴的で、最外層の膜はリボソームの付着した粗面小胞体と繋がっているが、同心球構造内部の膜は滑面状であり、小胞体内腔は非常に狭くなっているか、もしくは膜間間隙がほとんど見られなくなっていた。これらの特徴は筋分化誘導時と小胞体内カルシウム枯渇誘導時で共通していた。
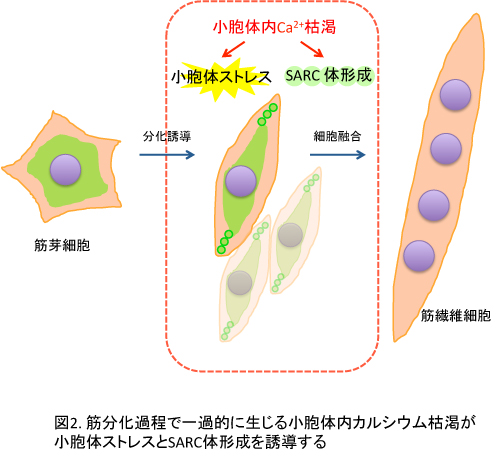
筋分化過程で一過的に生じる小胞体内カルシウム枯渇がSARC体形成と小胞体ストレスを引き起こす
筋分化誘導によって生じる小胞体膜由来球状構造が小胞体内カルシウム枯渇によって誘導される可能性が強く示唆されたことから、筋分化時における小胞体内カルシウム濃度変化を小胞体内カルシウムセンサーであるstromal interaction molecule 1 (STIM1)タンパク質の局在イメージングによって可視化することを試みた。小胞体膜貫通タンパク質であるSTIM1は小胞体カルシウム濃度が高く保たれている場合には小胞体膜上に均一に分布しているが、小胞体内カルシウム枯渇時には小胞体膜上で多量体を形成し、小胞体と細胞膜が近接している領域に局在するため顕微鏡下ではドットパターンとして観察される(5)。
蛍光タンパク質GFPを融合したSTIM1タンパク質をC2C12細胞内で発現させ、分化培地に移して経時的観察を行った結果、筋分化誘導後24時間前後に一過的にドットパターンが観察された(図1B)。小胞体ストレス応答タンパク質CHOPの発現は分化誘導後24時間から48時間で起こることから、STIM1によって可視化された小胞体内カルシウム枯渇は小胞体ストレス発生の直前に生じていると言える。これは筋分化に伴って生じる小胞体ストレスの原因が小胞体内カルシウム枯渇であることを支持する。私たちは小胞体内カルシウム枯渇時に生じる小胞体膜由来球状構造を、小胞体内カルシウム枯渇によるストレスが引き起こす応答(stress-activated response to ER Ca2+ depletion)という意味と、筋肉を表す英語の接頭辞sarcにかけてSARC 体と名付けた(図1A)。
SARC体が小胞体内カルシウム枯渇によって誘導される構造であることを阻害剤を用いた実験により検証した。C2C12細胞をサプシガルジンで処理すると同時に、小胞体からのカルシウム放出を担う主要なカルシウムチャネルであるイノシトール3リン酸(IP3)受容体及び筋形成とともに発現が上昇するカルシウムチャネルであるリアノジン受容体を阻害するとSARC体形成はほぼ完全に抑制された。この条件下では小胞体内カルシウムの出入りが同時に止められ、小胞体内カルシウム濃度が高く保たれていると考えられる。C2C12細胞を分化誘導条件におき、同時にIP3受容体とリアノジン受容体を阻害するとSARC体形成、小胞体ストレス応答、筋分化の全てが抑制された。これは小胞体内カルシウム枯渇が小胞体ストレスをはじめとするこれら全ての現象の上流にあることを強く示唆している(図2)。
おわりに
本研究によって、骨格筋の形成過程で生じる小胞体ストレスが小胞体内カルシウムの枯渇によって生じていることが強く示唆された。小胞体ストレスが筋分化にとって重要であることから、小胞体のカルシウム枯渇は分化過程にプログラムされた現象であると考えられる。プログラムされた小胞体内カルシウム枯渇がどのようにして生じるのか、SARC体はどのようなメカニズムで形成され、どのような機能を持つのか等、新たな謎が生まれた。この研究の発展が筋発生の制御機構についての理解を深め、更には老化や病気、怪我等による筋肉の衰えに対する治療法開発の一助となることを私たちは願っている。
参考文献
1. Nakanishi, K. et al. J. Cell Biol. 169, 555-560. (2005).
2. Bravo, R. et al. Int. Rev. Cell Mol. Biol. 301, 215-290 (2013).
3. Schroder, M. . Cell. Mol. Life Sci. 65, 862-894. (2008).
4. Al-Qusairi, L. and Laporte, J. Muscle 1:26. DOI:10.1186/2044-5040-1-26 (2011).
5. Wu, M. M. et al. J. Cell Biol. 174, 803-813. (2006).