Pro-IGF-II (Pro-Insulin-Like Growth Factor-II)は筋再生の自己増強作用を統合することにより、加齢による非効率的な再生反応を改善する
Tweet執筆者情報
執筆者:上住(池本)円、橋本有弘
執筆者所属:国立研究開発法人 国立長寿医療研究センター 再生再建医学研究部
原著論文:Pro-Insulin-Like Growth Factor-II Ameliorates Age-Related Inefficient Regenerative Response by Orchestrating Self-Reinforcement Mechanism of Muscle Regeneration. (Stem Cells 33:2456-2468, 2015)
更新日:2015年9月22日
概要
加齢により筋再生効率は低下するが、我々はその一因として、再生過程筋組織におけるpro-IGF-II発現の遅れと絶対量の減少を見出した。老化マウスへのpro-IGF-II補充は筋再生効率を改善させ、その効果はpro-IGF-IIによる骨格筋幹細胞(筋衛星細胞)の増殖及び血管新生の促進、間葉系前駆細胞の脂肪分化抑制を介して発揮されることを明らかにした。本研究から、pro-IGF-IIの補充は老化骨格筋の損傷に対する有効な治療法の一つとなり得ることが示唆された。
はじめに
サルコペニア(加齢に伴う筋肉量及び筋機能の低下)は高齢者に転倒や骨折のリスクを増加させるが、それに伴う筋損傷からの速やかな回復は、更なる心身の虚弱(フレイル)や要介護状態への進行を防ぐために必須である。加齢に伴う筋再生能力の変化については未だ一致した見解を得ておらず、加齢により筋再生能が障害されるという報告1-3がある一方で、筋再生は遅れるが最終的にほぼ完全に回復するという報告4, 5もある。
骨格筋は、発生の過程で筋芽細胞の融合により形成された多核で細長い筋細胞(筋線維と呼ばれる)が束を成した構造をとっている。筋線維は終末分化を果たした細胞で、その核は分裂能を持たないが、筋組織は優れた再生能を有している。骨格筋の再生は筋衛星細胞と呼ばれる単核の細胞が担っており、筋線維が壊死すると、筋衛星細胞が活性化し増殖、分化、融合を経て新たな筋線維を形成することで骨格筋は再生する。再生筋線維を生み出すだけでなく、一部の筋衛星細胞は自身が枯渇しないよう自己複製することが示されており、筋衛星細胞は骨格筋の幹細胞として機能している。
老化マウスにおける筋再生効率の低下と筋衛星細胞数の減少
まず、加齢により筋再生がどのような影響を受けるかを調べるため、老化マウス(24-30ヶ月齢)と若齢マウス(2-3ヶ月齢)の下肢筋(前脛骨筋)に蛇毒の一種であるcardiotoxinを投与し、筋損傷を誘導した。損傷7日後では老化マウスで明らかな再生能の低下が見られ、14日後にはその差が小さくなるものの、依然老化マウスの再生は不十分であった。最近、他のグループから、損傷30日後では筋再生の程度に差はないという報告がなされ6、加齢により筋再生は遅れるが、比較的長い回復期間を経れば再生可能である、つまり筋再生効率が低下していると考えられる。
筋再生効率低下の原因を明らかにするため、まず、加齢による筋衛星細胞数の変化を調べた。老化マウスと若齢マウスの下肢筋からコラゲナーゼ処理により単核の細胞を取り出し、筋衛星細胞を認識する抗体でラベル後、FACS (Fluorescence Activated Cell Sorting)により解析した。その結果、筋組織内の全単核細胞に対する筋衛星細胞の割合、および、筋重量当たりの筋衛星細胞数が老化マウスで約半分に減少していることが分かった。また、筋横断切片当たりのPax7(筋衛星細胞のマーカー)陽性筋衛星細胞数においても、老化マウスで顕著に減少していた。よって、加齢に伴い筋衛星細胞数は減少する。
筋衛星細胞の質的加齢変化ではなく、骨格筋内環境の加齢変化が筋再生効率の低下を引き起こす
加齢に伴う筋再生効率の低下が、筋衛星細胞数の減少だけでなく、筋衛星細胞の質的変化にも起因すると提唱されている一方、骨格筋組織内の環境変化に起因するとの主張もあり、未だ論争の的となっている。そこで、我々はこれについて独自に精査した。
まず、老化マウスと若齢マウスからFACSを用いて高純度に筋衛星細胞を単離し、in vitro培養系とin vivo移植によりその筋形成能を比較したが、両者に違いは認められなかった。一方、若齢マウス由来の筋衛星細胞を老化マウス及び若齢マウスの損傷筋に移植したところ、老化マウスへの移植により顕著な筋形成能の低下が認められた。これらの結果から、我々は、筋衛星細胞の質は維持されており、加齢による骨格筋内環境の変化が再生効率低下の決定的要因であると結論づけた。
老化再生筋でのpro-およびbig-IGF-II発現の遅れと絶対量の減少
加齢による筋組織内環境変化の実体を明らかにするために、老化マウスと若齢マウスの再生過程骨格筋を用いてサイトカイン抗体アレイ解析を実施し、老化で発現変動する因子を同定した。このうち、我々は老化再生筋で発現減少するIGF-IIに着目した。IGF-IIは筋損傷により誘導され、再生過程では成熟型ではなく、pro-及びbig-IGF-IIが発現していることを見出した。そして、老化によりその発現誘導が遅れるだけでなく、絶対量も減少することを明らかにした。
そこで、どの細胞がIGF-IIを産生するのかを調べた。IGF-IIは新生の再生筋線維から多量に分泌されるが、再生筋線維が形成される前では筋衛星細胞や間葉系前駆細胞(PDGFRα陽性細胞)7, 8からも分泌されることを見出した。老化マウスではこれらの細胞からのIGF-II産生量が減少し、これが組織IGF-IIレベルの低下を引き起こしていることを明らかにした。
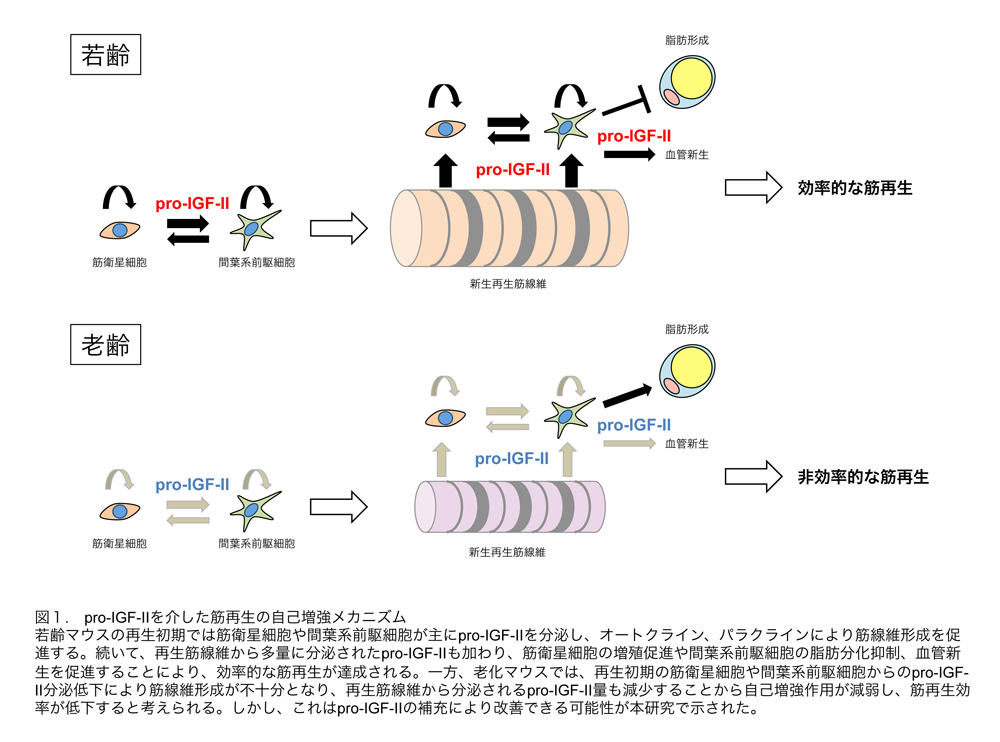
老化マウスへのpro-IGF-II補充は非効率的な筋再生反応を改善させ、その効果はpro-IGF-IIによる筋衛星細胞増殖および血管新生の促進、間葉系前駆細胞の異所性脂肪分化抑制を介して発揮される
そこで、老化マウスへのpro-IGF-II補充を試みた。浸透圧ポンプを用いて筋損傷4日目から7日間持続投与した。pro-IGF-II投与老化マウスでは、コントロール老化マウスに比べて残存壊死線維の顕著な減少や再生筋線維数の有意な増加が見られ、筋再生の改善が認められた。また、この改善効果はpro-IGF-IIによる筋衛星細胞の増殖および血管新生の促進、間葉系前駆細胞の異所性脂肪分化抑制を介して発揮されることを明らかにした。さらに、間葉系前駆細胞の脂肪分化抑制効果は成熟型では見られず、pro-IGF-IIに特異的な効果であることも見出した。
以上の結果から、pro-IGF-IIの補充は老化骨格筋の損傷に対する有効な治療法の一つとなり得ることが示唆された。
(クリックで拡大)
おわりに
本研究では、加齢による筋再生効率の低下が筋衛星細胞の質的加齢変化ではなく、骨格筋内環境の加齢変化によることを明らかにした。そして、この環境変化の1つとしてpro-IGF-IIの発現低下を見出し、老化マウスにpro-IGF-IIを補充することにより筋再生能力を改善できることを示した。以下に、本研究で明らかとなったpro-IGF-IIが仲介する筋再生の自己増強メカニズムについてまとめた(図1)。
参考文献
1. Sousa-Victor P, Gutarra S, Garcia-Prat L, et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 2014;506:316-321.
2. Cosgrove BD, Gilbert PM, Porpiglia E, et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature medicine. 2014;20:255-264.
3. Bernet JD, Doles JD, Hall JK, et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in skeletal muscle of aged mice. Nature medicine. 2014;20:265-271.
4. Smythe GM, Shavlakadze T, Roberts P, et al. Age influences the early events of skeletal muscle regeneration: studies of whole muscle grafts transplanted between young (8 weeks) and old (13-21 months) mice. Experimental gerontology. 2008;43:550-562.
5. Shavlakadze T, McGeachie J, Grounds MD. Delayed but excellent myogenic stem cell response of regenerating geriatric skeletal muscles in mice. Biogerontology. 2010;11:363-376.
6. Lee AS, Anderson JE, Joya JE, et al. Aged skeletal muscle retains the ability to fully regenerate functional architecture. Bioarchitecture. 2013;3:25-37.
7. Uezumi A, Fukada S, Yamamoto N, et al. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature cell biology. 2010;12:143-152.
8. Uezumi A, Ikemoto-Uezumi M, Tsuchida K. Roles of nonmyogenic mesenchymal progenitors in pathogenesis and regeneration of skeletal muscle. Frontiers in physiology. 2014;5:68.