JSAP1とJLPによる軸索輸送の制御とその破綻がもたらす神経変性の分子機構
Tweet執筆者情報
執筆者:佐藤時春、石川桃絵、善岡克次
執筆者所属:金沢大学 がん進展制御研究所 シグナル伝達研究分野
原著論文:JSAP1/JIP3 and JLP regulate kinesin-1-dependent axonal transport to prevent neuronal degeneration. (Cell Death Differ 22: 1260-1274, 2015)
更新日:2015年9月29日
概要
軸索輸送は神経細胞の成長と生存に不可欠であり、その障害は神経細胞死や神経変性疾患の直接の原因となる。しかし、軸索輸送制御とその破綻による神経変性機序については不明な点が多い。本研究で私たちは、JSAP1とJLP(JSAP1ファミリーメンバー)が軸索輸送の制御因子として働き、これらのタンパク質が欠失すると神経変性が誘導されることを見出した。さらに、軸索輸送制御の破綻が引き起こす神経変性の分子機構を明らかにした。
はじめに
軸索輸送は神経細胞の成長・生存および機能発現において極めて重要な役割を担っており、その障害は神経細胞死や神経変性疾患の直接の原因となる(1)。しかし、軸索輸送システムがどのように制御され、また、その破綻がどのようにして神経変性を引き起こすのか、これらの分子機構ついては不明な点が多い。一方、本研究で注目したJSAP1(c-Jun NH2-terminal kinase (JNK)/stress-activated protein kinase-associated protein 1, 別名JIP3)とJLP(JNK-associated leucine zipper protein)は、最初、細胞内情報伝達経路の特異性を規定する新規足場タンパク質として同定された(2-4)。その後の研究から、JSAP1とJLPはキネシンモーターや低分子量Gタンパク質ARF6などとの相互作用を介して細胞質分裂、細胞分化、軸索伸長等に関わる多機能性タンパク質ではないかと考えられるようになってきた(5-7)。しかし、これまでに得られている知見は断片的であり、統一的な理解には至っていなかった。そこで本研究では、JSAP1とJLPの機能的冗長性を考慮したin vivoおよびin vitro実験系を構築・解析することによって、JSAP1, JLPの新規機能を解明することを目的とした。さらに、JSAP1, JLPの機能破綻が引き起こす神経変性について、その分子機構解明を試みた。
JSAP1とJLPの二重欠損マウスにおける生育遅延と進行性の神経細胞脱落
JSAP1, JLPタンパク質は、脳で高い発現を示すことが知られている。そこで、Cre-loxPシステムを用いて、背側終脳特異的JSAP1, JLP二重欠損(Jsap1:Jlp cdKO)マウスの作出・解析を行った。その結果、Jsap1:Jlp cdKOマウスは生育遅延を起こし、生後5週間以内にすべて死亡することがわかった。また、Jsap1:Jlp cdKOマウスでは、側脳室の拡大、および大脳皮質2/3層・5層における神経細胞の進行性脱落が認められた。しかし、背側終脳特異的JSAP1(あるいはJLP)単独欠損マウスは正常に生育し、組織学的解析でも側脳室の拡大や神経細胞脱落は観察されなかった。これらの結果から、JSAP1とJLPは機能的冗長性を持ち、脳の発達において重要な役割を担っていること、さらに、JSAP1, JLP欠失は進行性の神経細胞脱落を誘導することが明らかになった。
軸索輸送におけるJSAP1とJLPの役割とその分子機構
神経細胞におけるJSAP1, JLPの役割を詳細に調べるために、JSAP1, JLP欠失が誘導可能な海馬神経細胞の初代培養系を構築した。このin vitro実験系は、Cre組換え酵素を発現させることによってJsap1, Jlp遺伝子の破壊が可能である。本研究ではCre発現アデノウイルス(Ad-Cre)を用い、まず、Ad-Cre感染後3日目(3 dpi)でJSAP1, JLPタンパク質が消失することを確認した。その後さらに解析を進め、軸索腫大、軸索変性、および神経細胞死が経時的(それぞれ7 dpi, 10 dpi, 14 dpi)に起こることを見出した。これらの結果から、JSAP1, JLPは軸索輸送に関与しており、JSAP1, JLP欠失による軸索輸送障害は神経変性(軸索変性・神経細胞死)を引き起こすことが示唆された。
JSAP1, JLPはキネシン-1と相互作用することが知られている。そこで、ミトコンドリアおよびアミロイド前駆体タンパク質(キネシン-1の積荷)に注目して、Ad-Cre感染3 dpiにおける軸索内での動きをタイムラプス法を用いて調べた。その結果、JSAP1, JLPが欠失した神経細胞では、順向性(キネシン依存性)軸索輸送の障害が認められた。キネシン-3の積荷(シナプトフィジン、シナプトタグミン-1)についても同様の解析を行ったが、JSAP1, JLP欠失による軸索輸送障害は検出できなかった。さらに、JSAP1(あるいはJLP)発現レンチウイルスを用いてレスキュー実験を行った。野生型JSAP1(あるいは野生型JLP)は、JSAP1, JLP欠失によるキネシン-1依存性の軸索輸送障害および神経変性をレスキューしたが、キネシン-1重鎖結合ドメインを欠く変異JSAP1(あるいは変異JLP)の場合には、レスキュー効果は認められなかった。
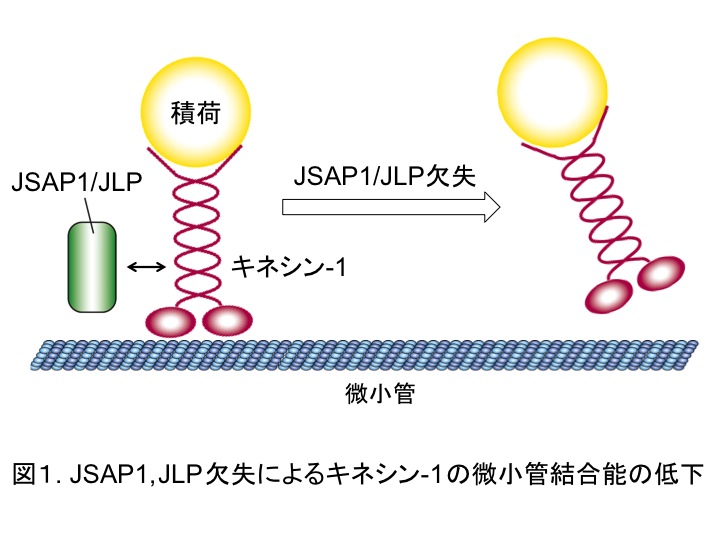
次に、軸索輸送制御におけるJSAP1, JLPの役割を明らかにするために、JSAP1, JLPとキネシン-1との相互作用に注目して、キネシン-1の微小管結合性を解析した。その結果、JSAP1, JLP欠失はキネシン-1の微小管結合能を低下させ(図1)、さらに、その結合能の低下は野生型JSAP1(あるいは野生型JLP)によってのみレスキューされることがわかった。
以上の結果から、JSAP1, JLPはキネシン-1の微小管結合能を制御する新規因子であり、軸索における多様な積荷の輸送制御を通じて神経細胞の生存維持に寄与すると考えられる。
軸索輸送制御の破綻がもたらす神経変性の分子機構
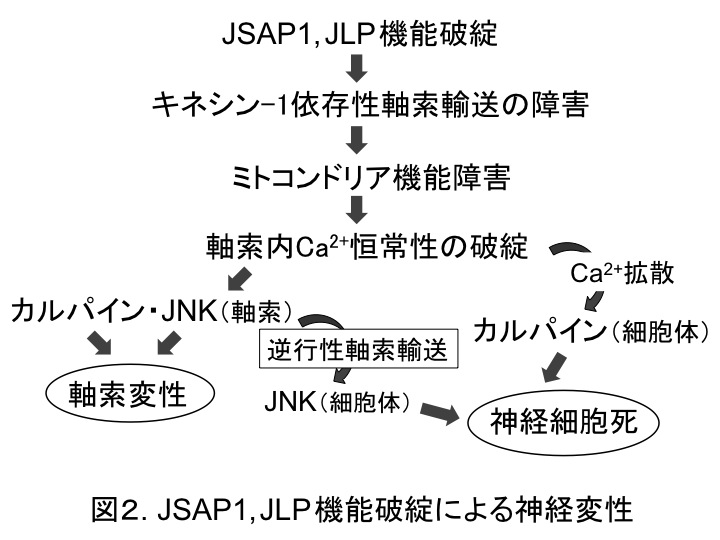
最後に、軸索輸送制御の破綻が、どのようにして神経変性を引き起こすのかを検討した。私たちは、ミトコンドリアの軸索輸送障害は軸索内ATP濃度の低下を招き、その結果、軸索内Ca2+濃度が上昇して、最終的に軸索変性・神経細胞死が引き起こされるのではないかと考えた。この仮説を検証するため、上述のin vitro実験系、ATeam(蛍光性ATPセンサー)(8)、およびG-CaMP7(蛍光性Ca2+センサー)(9)を用いて実験を行った。Ad-Cre感染5 dpiの軸索において、予想通り、ATP濃度の低下と Ca2+濃度の上昇が認められた。興味深いことに、そのCa2+濃度上昇により、JNKとカルパインが活性化することを見出した。また、JSAP1, JLP欠失に起因する神経変性には、JNKとカルパインの両者が必要であることも分かった。さらに、軸索内で活性化されたJNKが逆向性(ダイニン依存性)軸索輸送によって細胞体に運ばれ、神経細胞死に関わることを示唆する結果も得られた。以上のことから、JSAP1, JLP機能破綻は、図2に示すような機序によって神経変性を引き起こすと考えられる。
おわりに
アルツハイマー病やパーキンソン病に代表される神経変性疾患は、特定の神経細胞群が徐々に脱落する難病で、高齢者によく見られる。高齢化が深刻化する中、神経変性疾患は社会問題であり、治療法の開発と発症機序解明は急務である。本研究で私たちは、軸索輸送制御の破綻により、JNKとカルパインの活性が亢進し、それらが協調的に働くことによって神経変性が誘導されることを明らかにした。この研究成果は、JNK経路による翻訳後修飾を受けてカルパインの基質となる神経変性の鍵分子の存在を強く示唆している。この鍵分子を同定し、標的とすることによって、多くの神経変性疾患に有効な治療薬の開発につなげることができると考えている。
参考文献
1. Millecamps S, Julien JP. Nat Rev Neurosci 2013; 14: 161-176
2. Ito M, et al. Mol Cell Biol 1999; 19: 7539-7548
3. Kelkar N, et al. Mol Cell Biol 2000; 20: 1030-1043
4. Lee CM, et al. Proc Natl Acad Sci USA 2002; 99: 14189-14194
5. Tuvshintugs B, et al. Genes Cells 2014; 19: 692-703
6. Kobayashi H, et al. Biol Open 2014; 3: 803-814
7. Suzuki A, et al, FEBS Lett 2010; 584: 2801-2806
8. Imamura H, et al. Proc Natl Acad Sci USA 2009; 106: 15651-15656
9. Ohkura M, et al. PLoS One 2012; 7: e51286