TICAM-2偺嵶朎撪嬊嵼偲婡擻傪惂屼偡傞傾儈僲巁攝楍偺摨掕
Tweet幏昅幰忣曬
幏昅幰丗廙尒寬帣丄徏杮旤嵅巕丄悾扟巌
幏昅幰強懏丗杒奀摴戝妛戝妛堾堛妛尋媶壢丂柶塽妛暘栰
尨挊榑暥丗Identification of a Regulatory Acidic Motif as the Determinant of Membrane Localization of TICAM-2乮The Journal of Immunology 195:4456-4465, 2015乯
峏怴擔丗2015擭12寧1擔
奣梫
TICAM乮Toll/IL-1R domain-containing adaptor molecule乯-2偼TLR乮Toll-like receptor乯4偺傾僟僾僞乕暘巕偱偁傞丅TLR4偼僄儞僪僩僉僔儞偲偟偰抦傜傟傞儕億懡摐傪擣幆偟丄TIRAP乮Toll/IL-1R domain-containing adaptor protein乯-MyD88暋崌懱傪夘偟偰墛徢僔僌僫儖傪丄TICAM-2-TICAM-1暋崌懱傪夘偟偰I宆僀儞僞乕僼僃儘儞桿摫僔僌僫儖傪揱偊傞丅変乆偼TICAM-2偺婡擻夝愅傪峴偭偨寢壥丄TICAM-2偺僄儞僪僜乕儉枌傊偺嬊嵼傪婯掕偡傞偙偲偱丄TICAM-2僔僌僫儖偵廳梫側栶妱傪傕偮巁惈傾儈僲巁攝楍傪摨掕偟偨丅
偼偠傔偵
帺慠柶塽偼丄旝惗暔偵摿桳側僷僞乕儞暘巕傪擣幆偡傞僔僗僥儉偱丄惗懱杊屼宯偵偍偗傞弶婜墳摎傪扴偭偰偄傞丅堦曽偱丄妉摼柶塽偼儕儞僷媴偑拞怱偲側傝丄峈尨採帵嵶朎偵傛傞堎暔摿堎揑峈尨偺儕儞僷媴傊偺採帵偵傛偭偰丄帺慠柶塽傛傝傕挿偄帪娫傪偐偗偰妶惈壔偡傞丅偙偺妉摼柶塽偺妶惈壔偵偼帺慠柶塽偵傛傞巋寖偑昁恵偲側傞丅
帺慠柶塽偺妶惈壔偵偼丄堎暔摿堎揑側暘巕峔憿傪擣幆偡傞庴梕懱偑昁梫偱偁傞丅偙偺庴梕懱偼丄嵶朎撪晹偺儕僈儞僪傪擣幆偡傞RIG-I-like receptor傗Nod-like receptor丄嵶朎奜偺庴梕懱傪擣幆偡傞TLR傗C-lectin-like receptor摍偵暘椶偝傟傞1丅偙傟傜偺庴梕懱孮偼僷僞乕儞擣幆儗僙僾僞乕偲屇偽傟偰偍傝丄偑傫嵶朎傗僂僀儖僗偵桼棃偡傞懡摐椶丄帀幙丄妀巁摍傪儕僈儞僪偲偟偰擣幆偡傞丅
TLR偼僷僞乕儞擣幆儗僙僾僞乕偺拞偱嵟傕憗偔偐傜夝愅偑恑傫偱偄傞嘥宆枌娧捠僞儞僷僋幙偱丄僸僩偱偼10庬椶偺僒僽僞僀僾偺懚嵼偑抦傜傟偰偄傞丅TLR偼丄嵶朎昞柺偵嬊嵼偟偰嵶朎奜偵偁傞儕僈儞僪傪擣幆偡傞傕偺乮TLR1, 2, 4, 5, 6, 10乯偲丄僄儞僪僜乕儉偵嬊嵼偟偰僄儞僪僒僀僩乕僔僗偵傛偭偰嵶朎撪晹偵庢傝崬傑傟偨儕僈儞僪傪擣幆偡傞傕偺乮TLR3, 4, 7, 8, 9乯偵戝暿偝傟丄嵶朎幙偵懚嵼偡傞傾僟僾僞乕暘巕 (TICAM-1, TICAM-2, MyD88, Mal/TIRAP)傪夘偟偰墛徢惈僒僀僩僇僀儞傗I宆僀儞僞乕僼僃儘儞偺揮幨傪桿摫偡傞丅
TLR傗偦偺傾僟僾僞乕暘巕偼丄TIR僪儊僀儞偲屇偽傟傞嫟捠偺僪儊僀儞峔憿傪桳偡傞2丅TIR僪儊僀儞偼丄TLR偺嵶朎撪僪儊僀儞丄媦傃TLR僔僌僫儖傪拠夘偡傞嵶朎撪傾僟僾僞乕暘巕偵懚嵼偡傞丅TLR傪夘偟偨僔僌僫儖揱払偵偼TIR僪儊僀儞摨巑偺寢崌偑昁恵偱偁傞丅
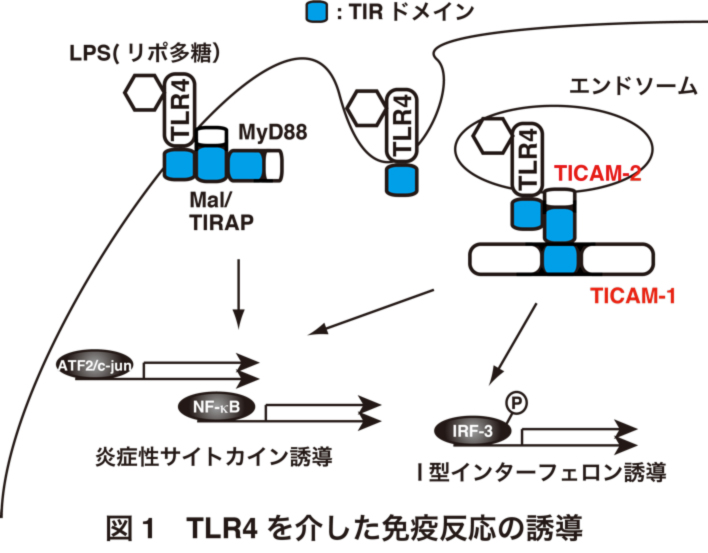
変乆偼偙傟傑偱偺尋媶偱丄TLR巋寖偵傛傞嵶朎撪僔僌僫儖揱払偵昁恵側傾僟僾僞乕暘巕傪2庬椶摨掕偟偨乮TICAM-1偲TICAM-2乯3,4丅TICAM-1偼丄TLR3巋寖偲僄儞僪僜乕儉偐傜偺TLR4巋寖偵傛傞僔僌僫儖揱払偵昁恵偺傾僟僾僞乕暘巕偱偁傞丅TICAM-1偼丄TLR3傗TLR4偺儕僈儞僪擣幆偵敽偭偰妶惈壔偟丄摿偵I宆僀儞僞乕僼僃儘儞嶻惗傪嫮椡偵桿摫偡傞丅TLR3偼丄TICAM-1偵捈愙寢崌偡傞偙偲偱僔僌僫儖偑擖傞偺偵懳偟偰丄TLR4偼TICAM-1偲捈愙偵偼寢崌偟側偄丅TICAM-2偼丄僄儞僪僜乕儉偐傜偺TLR4巋寖偵傛傞僔僌僫儖揱払偵昁恵側傾僟僾僞乕暘巕偱偁傞丅TICAM-2偼丄TLR4偲TICAM-1偺椉曽偲寢崌偡傞偙偲偱丄僄儞僪僜乕儉偵偍偗傞TLR4偐傜偺巋寖傪TICAM-1偵揱偊傞壦嫶暘巕偲偟偰婡擻偡傞乮恾1乯丅TLR4偼丄嵶朎昞柺偱偼MyD88偲Mal/TIRAP偲屇偽傟傞傾僟僾僞乕暘巕偲暋崌懱傪宍惉偟丄摿偵墛徢惈僒僀僩僇僀儞嶻惗傪嫮椡偵桿摫偡傞乮恾1乯丅TLR4偺儕僈儞僪偱偁傞儕億懡摐偼僌儔儉堿惈嬠偺奜枌峔惉惉暘偱偁傝丄MyD88, TICAM-1椉曽偺妶惈壔偵壛偊偰丄僇僗僷乕僛傪妶惈壔偡傞偙偲偱抳巰揑慡恎墛徢傪桿婲偟偆傞偙偲偐傜丄僄儞僪僩僉僔儞偲偟偰抦傜傟偰偄傞丅
TICAM-2偺棫懱峔憿夝愅
TLR4偲TICAM-2丄媦傃TICAM-1偲TICAM-2偺憡屳嶌梡偵偮偄偰棟夝偡傞忋偱丄TIR僪儊僀儞偺棫懱峔憿偼廳梫側庤偑偐傝偲側傞丅偦偙偱丄変乆偼TICAM-1偲TICAM-2偵偮偄偰丄X慄寢徎峔憿夝愅偲NMR朄傪梡偄偰TIR僪儊僀儞偺棫懱峔憿傪寛掕偟偨5丅摼傜傟偨峔憿僨乕僞偵婎偯偄偰TICAM-1偲TICAM-2偺暋崌懱偺峔憿傪梊應偟偨寢壥丄TICAM-2偵偍偗傞87斣栚偐傜89斣栚偺巁惈傾儈僲巁攝楍偑憡屳嶌梡偵廳梫側栶妱傪壥偨偡偲峫偊傜傟偨丅
TICAM-2偺婡擻偵廳梫側傾儈僲巁攝楍偺摨掕
偙偺峔憿忣曬偐傜偺梊應偑幚嵺偺寢崌條幃偲崌抳偟偰偄傞偙偲傪妋偐傔傞偨傔丄攟梴嵶朎偵偍偗傞TICAM-1偲TICAM-2偺寢崌偵偮偄偰柶塽捑崀朄偵傛偭偰夝愅偟偨丅HEK293嵶朎偵敪尰偝偣偨栰惗宆TICAM-2偼丄TICAM-1偲偺寢崌偑娤嶡偝傟偨丅偙傟偵懳偟偰丄87斣栚偐傜89斣栚偺巁惈傾儈僲巁巆婎傪傾儔僯儞偱抲姺偟偨TICAM-2 (E87A/D88A/D89A) 曄堎懱偱偼丄TICAM-1 偲偺寢崌偑庛偔側偭偰偍傝丄幚嵺偺嵶朎撪偵偍偗傞TICAM-1偲TICAM-2偺憡屳嶌梡偵偙偺儌僠乕僼偑廳梫偱偁傞偙偲偑帵嵈偝傟偨丅
傑偨丄曄堎懱傪嫮惂敪尰偝偣偨嵺偺壓棳偺僔僌僫儖偵偮偄偰傕夝愅偟偨丅TICAM-2傪攟梴嵶朎偵嫮惂敪尰偝偣傞偲TICAM-1傪夘偟偨僔僌僫儖偑妶惈壔 偟丄I宆僀儞僞乕僼僃儘儞偱偁傞僀儞僞乕僼僃儘儞兝堚揱巕偺揮幨偑妶惈壔偝傟傞丅偙傟偵懳偟偰丄TICAM-2 (E87A/D88A/D89A) 曄堎懱偱偼僀儞僞乕僼僃儘儞兝堚揱巕偺揮幨妶惈偑尠挊偵尭彮偟偰偄偨丅堦曽偱丄91斣栚偲92斣栚偺巁惈傾儈僲巁巆婎傪傾儔僯儞偱抲姺偟偨TICAM-2 (D91A/E92A) 曄堎懱偱傕丄僀儞僞乕僼僃儘儞兝偺揮幨妶惈偑尠挊偵尭彮偟偰偄偨丅偙偺曄堎懱偱偼丄TICAM-1偲TICAM-2偺嵶朎撪偵偍偗傞寢崌擻偼栰惗宆TICAM-2偲摨掱搙擣傔傜傟偨丅偙偺偙偲偐傜TICAM-2 (D91A/E92A) 曄堎懱偼丄TICAM-1偲偺寢崌擻偑掅壓偡傞TICAM-2乮E87A/D88A/D89A) 曄堎懱偲偼堎側傞嶌梡婡彉偱僀儞僞乕僼僃儘儞兝偺揮幨妶惈偑掅壓偟偨偲峫偊傜傟偨6丅
TICAM-2偺嵶朎撪嬊嵼傪夘偟偨婡擻惂屼
TICAM-2偺傾儈僲枛抂偵偼丄帀幙廋忺偺堦庬偱偁傞儈儕僗僠儖壔傪桿摫偡傞僔僌僫儖攝楍偑懚嵼偡傞丅儈儕僗僠儖壔偝傟偨暘巕偼丄帀幙憡屳嶌梡偵傛偭偰僄儞僪僜乕儉偺帀幙2廳憌偲夛崌偡傞丅TICAM-2傪夘偟偨僔僌僫儖揱払偵偼丄偙偺帀幙2廳憌傊偺夛崌偑昁恵偱偁傞7丅栰惗宆TICAM-2偲TICAM-2 (D91A/E92A) 曄堎懱偵偮偄偰嵶朎撪嬊嵼傪尠旝嬀偱娤嶡偟偨偲偙傠丄栰惗宆偺TICAM-2偑嵶朎枌丄媦傃僄儞僪僜乕儉枌傊嬊嵼偟偨偺偵懳偟偰丄TICAM-2 (D91A/E92A) 曄堎懱偱偼嬊嵼偑嵶朎幙傊偲曄壔偟偰偄偨丅偝傜偵丄栰惗宆TICAM-2偲TICAM-2 (D91A/E92A) 曄堎懱傪偦傟偧傟攟梴嵶朎偵嫮惂敪尰偝偣丄嵶朎傪攋嵱偟偰嵶朎枌惉暘偲嵶朎幙惉暘偵暘夋偟偨偲偙傠丄栰惗宆TICAM-2偼嵶朎枌夋暘偲嵶朎幙夋暘偺椉曽偐傜専弌偝傟偨偺偵懳偟偰丄TICAM-2 (D91A/E92A) 曄堎懱偼嵶朎幙夋暘偵偺傒専弌偝傟偨丅埲忋偺寢壥偐傜丄TICAM-2 (D91A/E92A) 曄堎懱偼帀幙2廳憌偵夛崌偡傞擻椡傪幐偭偰偄傞偲峫偊傜傟偨丅偙傟偵懳偟偰丄栰惗宆偲曄堎懱偺TICAM-2偵偮偄偰儈儕僗僠儖壔傪挷傋偨偲偙傠丄椉暘巕偵偮偄偰摨偠傛偆偵儈儕僗僠儖壔偑娤嶡偝傟偨丅偙偺寢壥偐傜丄TICAM-2偑枌傊偺嬊嵼傪帵偡偨傔偵偼丄儈儕僗僠儖壔偩偗偱偼晄廫暘偱偁傞偲峫偊傜傟偨丅
廔傢傝偵
杮尋媶偱摼傜傟偨寢壥偐傜丄TICAM-2偵偼TICAM-1偲偺寢崌偵捈愙婑梌偡傞87偐傜89斣栚偺巁惈傾儈僲巁攝楍偺懠偵丄TICAM-2偺妶惈壔偵廳梫側嵶朎撪嬊嵼傪婯掕偡傞91偲92斣栚偺巁惈傾儈僲巁攝楍偑懚嵼偡傞偙偲偑柧傜偐偲側偭偨乮恾2乯丅崱夞柧傜偐偲側偭偨怴偟偄TICAM-2偺婡擻晹埵偺忣曬偼丄儕億懡摐巋寖偵傛傞柶塽斀墳傪惂屼偡傞偨傔偺庤偑偐傝偲側傞偙偲偑婜懸偱偒傞丅
嶲峫暥專
1. Brubaker, S.W., Bonham, K.S., Zanoni, I. & Kagan, J.C. Innate immune pattern recognition: a cell biological perspective. Annual review of immunology 33, 257-290 (2015).
丂2. Gay, N.J., Symmons, M.F., Gangloff, M. & Bryant, C.E. Assembly and localization of Toll-like receptor signalling complexes. Nat Rev Immunol 14, 546-558 (2014).
丂3. Oshiumi, H., Matsumoto, M., Funami, K., Akazawa, T. & Seya, T. TICAM-1, an adaptor molecule that participates in Toll-like receptor 3-mediated interferon-beta induction. Nat. Immunol. 4, 161-167 (2003).
丂4. Oshiumi, H., et al. TIR-containing adapter molecule (TICAM)-2, a bridging adapter recruiting to toll-like receptor 4 TICAM-1 that induces interferon-beta. J. Biol. Chem. 278, 49751-49762 (2003).
丂5. Enokizono, Y., et al. Structures and interface mapping of the TIR domain-containing adaptor molecules involved in interferon signaling. P Natl Acad Sci USA 110, 19908-19913 (2013).
丂6. Funami, K., et al. Identification of a Regulatory Acidic Motif as the Determinant of Membrane Localization of TICAM-2. J. Immunol. 195, 4456-4465 (2015).
丂7. Rowe, D.C., et al. The myristoylation of TRIF-related adaptor molecule is essential for Toll-like receptor 4 signal transduction. Proc. Natl. Acad. Sci. U S A 103, 6299-6304 (2006).