制御性T細胞の抗原レセプターの多様性は、腸管組織の恒常性維持に必要である
Tweet執筆者情報
執筆者:西尾純子
執筆者所属:東京大学生産技術研究所・炎症・免疫制御学社会連携研究部門
原著論文:Requirement of full TCR repertoire for regulatory T cells to maintain intestinal homeostasis(PNAS 112:12770-12775, 2015)
更新日:2015年12月18日
概要
制御性T細胞(Treg細胞)は、腸管組織の恒常性維持に重要な役割を持つことが示唆されているが、その働きは未だ明らかでない点が多い。本研究では、腸管組織の恒常性を維持するために、Treg細胞のT細胞レセプター(TCR)が十分な多様性を持つことが重要であることを示した。多様性があるTreg細胞は、腸内細菌により活性化された遊走性樹状細胞を制御することにより、腸内細菌に対する免疫寛容を成立させ、T細胞の活性化を抑制し、末梢性Treg細胞の分化を促進する。その結果、大腸組織の恒常性が維持されると考えられた。
はじめに
腸管では、腸内常在細菌に対する免疫反応が巧みに制御されることにより、腸管組織の恒常性が維持されている。適応免疫細胞であるT細胞やB細胞は、多様な抗原レセプターを細胞上に発現し、様々な病原体を特異的に認識して免疫反応を起こすという特徴を持っており、それらの抗原レセプターの多様性は極めて重要である。
一方、免疫システムには、末梢の自己組織に対する免疫反応を抑制する機構(免疫寛容)が存在する。その抑制機構の主役が、T細胞の一亜群であるTreg細胞である。Treg細胞はそのほとんどが胸腺で分化し、胸腺をでた後に末梢組織に広く分布するが、一部のTreg細胞は末梢でナイーブT細胞から分化することがあり、この細胞群は末梢性Treg細胞(peripherally derived Treg細胞; pTreg細胞)と呼ばれる。いずれのTreg細胞も、様々な機構で様々な免疫細胞の反応を制御している。
腸管では1兆個を超える腸内細菌が存在し、それらにより腸管免疫細胞は常時刺激されている。それにもかかわらず、常在菌に対して強い免疫反応は起こらず、結果として宿主と常在菌は良い共生関係が維持されている。この共生関係を成立させるためには、腸管免疫細胞は常在菌に対して免疫寛容の仕組みが成り立っていることが示唆される。 Treg細胞は他の組織よりも大腸に多く存在していることから、常在菌に対する免疫寛容の成立にはTreg細胞が寄与していることが推測されている。
こうした背景から、著者らは腸管組織の恒常性維持に必要な、腸内細菌に対する免疫寛容の維持に、Treg細胞のTCRの多様性が必要か否かを検討した。
結果
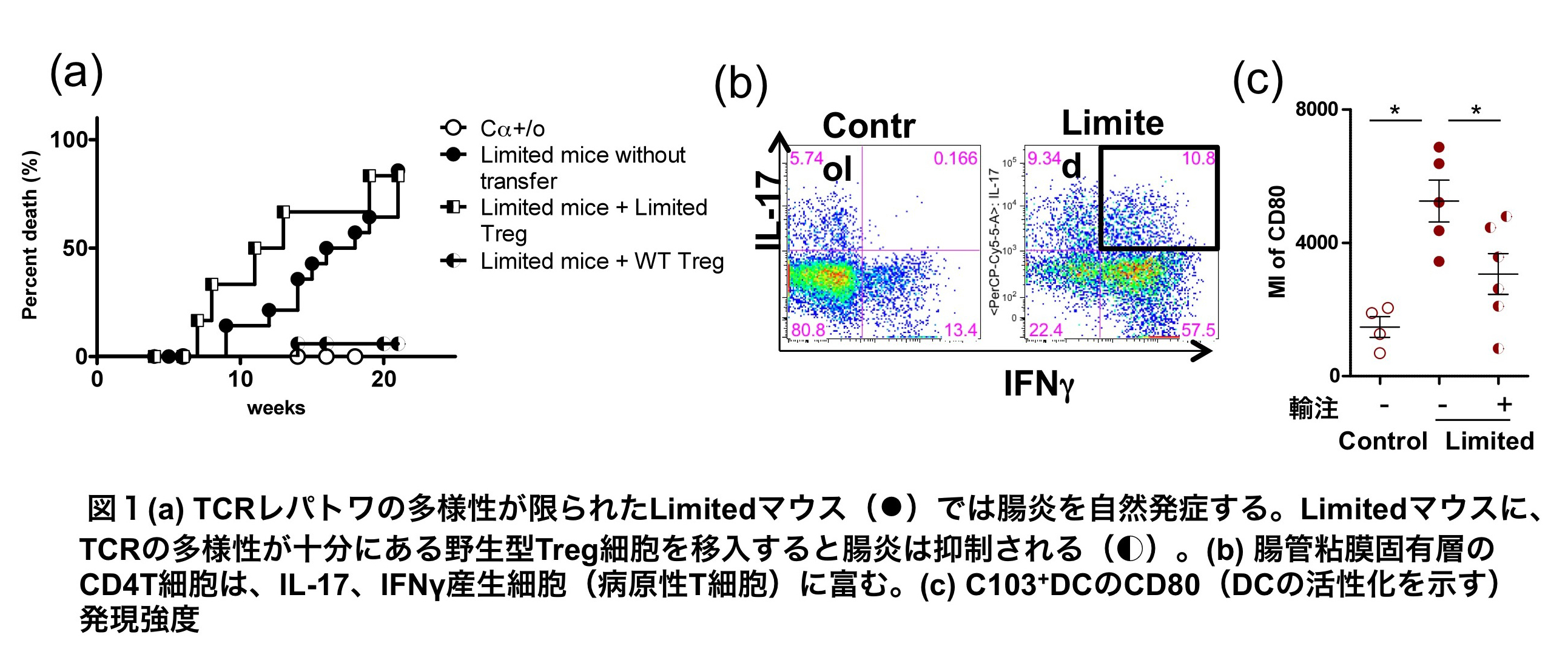
腸管組織の恒常性維持にTreg細胞のTCRの多様性が必要かを調べるため、TCRの多様性が正常の1/1000程になる遺伝子変異マウス(Limitedマウス)を利用した。興味深いことに、Limitedマウスは10週齢頃から慢性腸炎の症状(下痢や脱肛)を呈し始め、20週齢頃にはほとんどのマウスが腸炎を発症した(図1a)。大腸組織切片HE染色では、粘膜固有層の単核球浸潤や腸管上皮過形成を認めた。粘膜固有層浸潤細胞をフローサイトメトリーで解析すると、IL-17産生ヘルパーT細胞(Th17細胞)、及びインターフェロンγ産生Th17細胞(IFNγ+Th17細胞)が、野生型マウスと比較して極めて増加していた(図1b)。IFNγ+Th17細胞は、病因性T細胞として知られており、ヒトの潰瘍性大腸炎やクローン病でも増加することが知られている。IFNγ+Th17細胞の増加は腸炎が発症する前より認められたことから、Limitedマウスの腸炎は病因性IFNγ+Th17細胞による腸炎と考えられた。
Limitedマウスの腸炎が腸内細菌の存在によって生じるか否かを検討するために、このマウスに抗生剤を投与し腸内細菌を除去すると、Th17細胞とIFNγ+Th17細胞の数は野生型マウスと同等に正常化した。また、腸内細菌に特異的な16S ribosomal DNAの定量的PCRを行うことにより、腸内細菌叢の構成を比較したが、野生型マウスとの間に差を認めなかった。これらの結果から、TCRレパトワの多様性が低いことで腸内細菌に対する免疫寛容の破綻が生じ、腸炎が自然発症すると考えられた。
前述のように、Treg細胞が大腸粘膜において腸内細菌に対する免疫寛容を担っていることが示唆されたことから、LimitedマウスのTreg細胞の頻度(T細胞内の割合)や、コンベンショナルT細胞(Treg細胞ではないT細胞)の増殖に対する抑制能を調べたが、野生型マウスと差はなかった。しかし、野生型のTreg細胞をLimitedマウスに移入すると腸炎は抑制され(図1a)、粘膜固有層のTh17細胞とIFNγ+Th17細胞頻度も正常化した。さらに、野生型Treg細胞の移入によるTreg細胞頻度の上昇が見られなかったことから、野生型Treg細胞の全体数が増加したのではなく、より抑制能のあるTreg細胞が増えたことにより腸炎が抑えられたと考えられた。
以上の結果から、in vivoでは十分に多様なTCRを持つ野生型マウスのTreg細胞が、樹状細胞(DC)を介してTh17細胞とIFNγ+Th17細胞による炎症を制御している可能性を考え、大腸の樹状細胞について調べた。腸管の樹状細胞は、主に遊走性樹状細胞(migratory DC; migDC)と居住性樹状細胞(resident DC)に分けられ、migDCはCD103陽性(CD103+)、resident DCはCD103陰性(CD103-)細胞として区別される。腸炎発症前のCD103+DCとCD103-DCの数は、野生型とLimitedマウスの間で差はなかったが、DCの活性化マーカーであるCD80、CD86の発現レベルを比較すると、LimitedマウスのCD103+DCで著しく発現が高く、活性化していることが示された(図1c)。CD80とCD86の発現レベルは、野生型のTreg細胞の移入で有意に低下することから、大腸粘膜では十分な多様性を持つTreg細胞がCD103+DCの活性化を制御することにより、Th17細胞とIFNγ+Th17細胞による炎症を制御していることが示唆された。
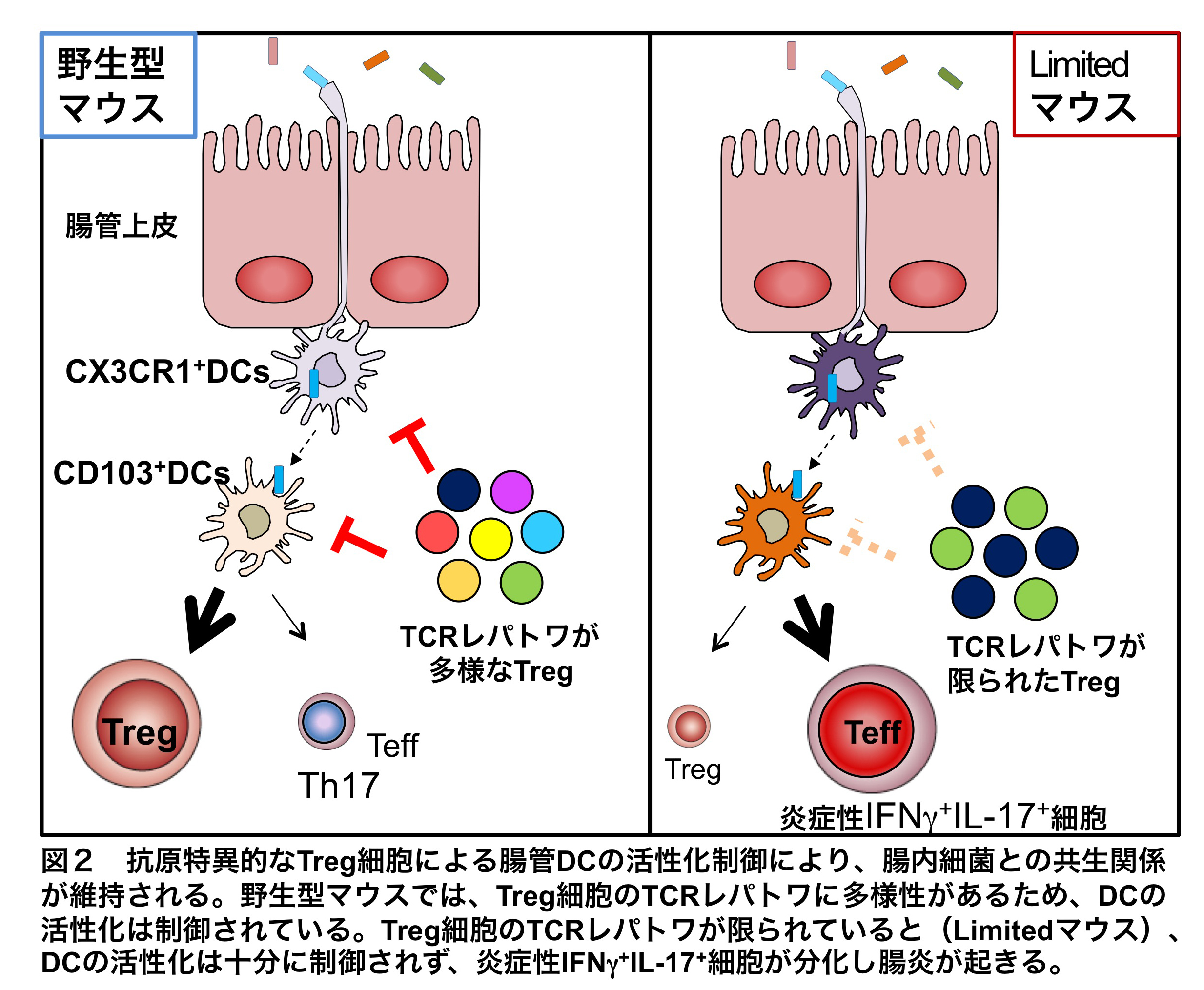
この、十分に多様なTCRを持つTreg細胞に制御された定常状態におけるCD103+DCが、どのようなフェノタイプを持つのかを調べるために、野生型マウスとLimitedマウスのCD103+DCをそれぞれ採取し、マイクロアレイ解析により遺伝子発現を網羅的に解析した。その結果、LimitedマウスのCD103+DCでは、定常状態のmigDCにおいて発現が亢進している遺伝子群の発現が全体的に低下していた。一方で、野生型マウスに比べLimitedマウスでは、ケモカインやそのレセプター、自然免疫受容体であるTLRやCLR、補体やFcレセプターなど、DCの活性化を示唆する遺伝子、中でもTh17の誘導に必須であるIL-1β、IL-6、TGFβをコードする遺伝子の発現が高かった。さらに、腸管CD103+DCは、自身のretinaldehyde dehydrogenase 2(RALDH2)活性によりpTreg細胞分化を促進する。LimitedマウスのCD103+DCでは、このRALDH2の発現が低下していた。これらから、LimitedマウスではTreg細胞のTCRの多様性が低いため、腸内細菌によって活性化されたmigDCがTreg細胞によって制御されず、Th17細胞分化が促進し、pTreg細胞分化が低下することが示唆された。
以上の結果を図2にまとめた。LimitedマウスではTreg細胞のTCRの多様性が低いため、腸内細菌に活性化されたCD103+migDCを十分に制御することができず、コンベンショナルT細胞がTh17やIFNγ+Th17細胞へと分化し腸炎が起きる。しかし、正常マウスではTreg細胞のTCRの多様性が十分であるためにCD103+migDCの制御が可能で、コンベンショナルT細胞の活性化を抑制し、末梢性Treg細胞の分化を促進する結果、腸管組織の恒常性が維持されると考えられた。本研究は、腸管組織の恒常性維持において、Treg細胞のTCR多様性の重要性を発見したという点で極めて意味があると考えている。