FBXL12によるALDH3の分解はトロホブラストの分化に必須である
Tweet執筆者情報
執筆者:西山正章、中山敬一
執筆者所属:九州大学 生体防御医学研究所 細胞機能制御学部門 分子医科学分野
研究室Website:http://www.bioreg.kyushu-u.ac.jp/saibou/index.html
原著論文:FBXL12-Mediated Degradation of ALDH3 is Essential for Trophoblast Differentiation During Placental Development(Stem Cells 33:3327-3340, 2015)
更新日:2015年12月23日
概要
幹細胞がどのようにその性質(幹細胞性)を維持し、幹細胞状態から分化を開始するかについてはほとんど不明のままである。アルデヒド脱水素酵素(ALDH)はあらゆる幹細胞で活性が高いことが知られており、その活性は幹細胞性の維持に不可欠であるが、ALDH活性を制御するメカニズムはほとんど明らかになっていない。われわれは胎盤の分化過程において、F box and leucine-rich repeat protein 12(FBXL12)によって調節されるALDH3のユビキチン依存性分解が栄養膜幹細胞(TSC)の分化プログラムの開始に必須であることを明らかにした。
はじめに
ALDHは、NADまたはNADPを補酵素としてアルデヒドをカルボン酸に酸化する酵素ファミリーに属する。近年、様々なALDHの活性上昇が正常幹細胞やがん幹細胞で観察され、その発現と活性は様々な幹細胞の同定および単離のための指標となっている(文献1,2)。これらの事実は、ALDHが幹細胞の自己保護、増殖および分化において重要な役割を果たしているだけでなく、幹細胞からの分化を抑制していることを示唆している。
胎盤に存在するTSCは、哺乳類の発生期において胎盤細胞系譜を産生する根源的な存在である(文献3)。幹細胞の特徴である自己複製と多方向性分化のバランスは胎盤組織の構築に重要である。最近、ユビキチン・プロテアソーム系を介したタンパク質の量的制御がTSCの正常な機能のために重要であり、その破綻が胎盤の発生異常を来すことが示唆されているが(文献4)、これらの役割を担うユビキチンリガーゼ(E3)の正体は不明であった。
SCF-FBXL12は胎盤特異的ユビキチンリガーゼである
SCF複合体は多量体型E3であり、3つの不変サブユニット(Skp1、Cul1およびRbx1)とF-boxタンパク質と呼ばれる基質認識を担う1つの可変サブユニットから構成されている(Skp1、Cul1、F-boxの頭文字をとってSCF)(文献5)。われわれは、ほとんどのF-boxタンパク質が進化において保存されているのに対し、FBXL12は胎盤を有する哺乳類にのみ存在することに着目した。マウス胚発生期において、FBXL12は胎仔よりも胎盤に多く発現しており、さらに免疫組織化学的解析によって、胎盤のjunctional zoneに特異的に発現していることを明らかにした。これらの結果から、FBXL12が胎盤の発生や機能に重要な役割を果たしている可能性が示唆された。
ディファレンシャルプロテオミクスによるSCF-FBXL12の基質の同定
FBXL12の基質を同定するために、以前にわれわれが開発したDiPIUS(differential proteomics-based identification of ubiquitylation substrates)と呼ばれるディファレンシャルプロテオミクスを利用した(文献6)。野生型FBXL12とF-ボックスドメインを欠く変異体(FBXL12(ΔF))のそれぞれに結合したタンパク質の存在量を比較することによって、最も可能性の高い基質候補としてALDH3A1を同定した。また、ALDH3A2も基質候補に含まれた。共免疫沈降解析によって、FBXL12がALDH3ファミリーメンバーとだけ相互作用し、ALDH1ファミリーメンバーとはほとんど結合しないことが明らかになった。野生型FBXL12はin vivoでALDH3A1のポリユビキチン化を促進するのに対し、FBXL12(ΔF)は促進しないことがわかった。またin vitroでのユビキチン化アッセイによって、ALDH3がSCFFBXL12(Skp1、Cul1、Rbx1、FBXL12の複合体)の直接の基質であることが示唆された。さらにシクロヘキシミドチェイス解析を行い、FBXL12ノックダウン細胞ではALDH3A1の分解がほぼ完全に阻害されることを明らかにした。これらの結果から、SCFFBXL12がALDH3ファミリーに特異的なE3であることが強く示唆された。
FBXL12ノックアウトマウスの胎盤発生異常と子宮内発育遅延
FBXL12の生理機能を解明するために、われわれはFBXL12ノックアウトマウス(FBXL12 KO)を作製した。FBXL12 KOは胎生13.5日目頃から胎仔の発育遅延および胎盤サイズの減少が観察され(図1左)、ほとんどは胎生期または周産期に死亡した。胎盤サイズの減少は胎仔よりも顕著で、FBXL12が胎仔よりも胎盤で高発現していることを考えると、ノックアウト胎仔の発育遅延は胎盤機能不全に伴う二次的なものと思われた。胎盤切片のヘマトキシリン・エオシン染色(HE染色)では、ノックアウト胎盤においてjunctional zoneが形成されていないようにみえた(図1右)。この所見と一致して、junctional zoneの構成細胞である海綿状栄養膜細胞のマーカーTpbpaの発現とグリコーゲン細胞のマーカーPcdh12の発現が、ノックアウト胎盤で著しく減少していた。またイムノブロット解析を行ったところ、野生型胎盤に比べてノックアウト胎盤ではALDH3A1とALDH3A2の発現量が増加しているのに対し、ALDH1A1の発現量には差がみられなかった。これらの結果から、ノックアウト胎盤ではALDH3の蓄積によりjunctional zoneの形成が障害されていることが示唆された。
FBXL12はALDH3を分解することにより胎盤細胞の分化を制御する
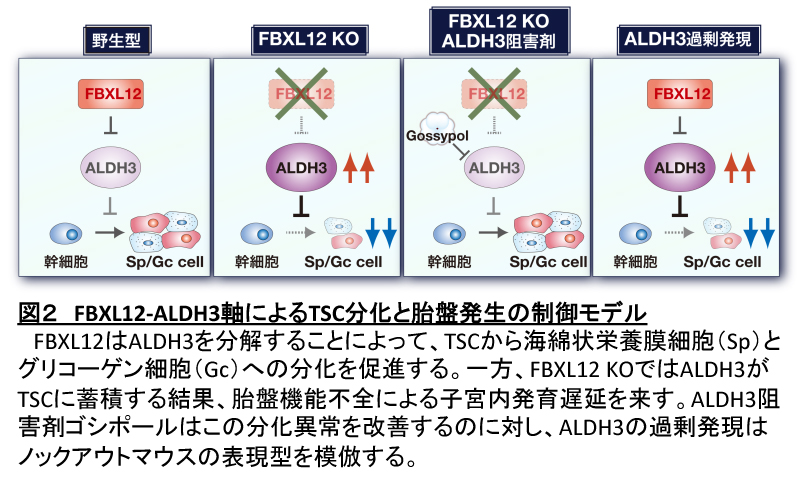
次にわれわれは、TSCの試験管内分化におけるFBXL12枯渇の効果について検討した。TSCにおけるFBXL12の枯渇は、ノックアウト胎盤と同様にALDH3A1の蓄積をもたらし、TpbpaとPcdh12の発現誘導を阻害した。ALDH3阻害剤であるゴシポールをTSCに投与すると、Tpbpaの発現誘導が部分的に回復したことから、FBXL12枯渇による分化異常はALDH3の発現量増加によるものであることが示唆された。実際にALDH3の蓄積がFBXL12枯渇によるTSCの分化異常の原因であるかどうかを検証するために、われわれはTSCの分化におけるALDH3A1の過剰発現の効果を調べた。ALDH3A1の過剰発現は、FBXL12枯渇によって誘導されるのと同程度にTpbpaの発現誘導を抑制した。一方、ALDH1A1の過剰発現はこの効果を示さなかった。これらの結果から、FBXL12がALDH3を分解することによって、TSCが幹細胞状態から海綿状栄養膜細胞またはグリコーゲン細胞への分化を開始することが示唆された(図2)。
おわりに
われわれの解析結果から、ALDH3がSCFFBXL12の主要な基質であり、FBXL12は海綿状栄養膜細胞またはグリコーゲン細胞への分化を調節するために、TSC内の適切なALDH活性の維持に重要な役割を果たしていることが明らかになった。ALDH活性は多くのタイプの幹細胞に不可欠であることを考えると、TSC以外の幹細胞においても、別のE3が他のALDHを標的にしている可能性がある。腫瘍細胞においてALDHの発現増加が抗がん剤に対する耐性に寄与することが示されており(文献7)、それはがん幹細胞の化学療法抵抗性の増加に基づくものかもしれない。ALDH活性の制御機構を詳細に解明することによって、幹細胞状態を維持するメカニズムの理解が深まるだけでなく、新規のがん治療法の開発に繋がる可能性がある。
参考文献
1. Storms, R. W. et al. : Proc Natl Acad Sci U S A 96 : 9118-9123, 1999
2. Ginestier, C. et al. : Cell Stem Cell 1 : 555-567, 2007
3. Soares, M. J. et al. : Placenta 17 : 277-289, 1996
4. Townley-Tilson, W. H. et al. : PLoS One 9 : e89451, 2014
5. Nakayama, K. I. & Nakayama, K. : Nat Rev Cancer 6 : 369-381, 2006
6. Yumimoto, K. et al. : J Proteome Res 11 : 3175-3185, 2012
7. Sladek, N. E. : Curr Pharm Des 5 : 607-625, 1999