LRRC59は小胞体においてUNC93B1を介した核酸認識TLRの輸送を制御する
Tweet執筆者情報
執筆者:立松恵、松本美佐子
執筆者所属:北海道大学大学院医学研究科 免疫学分野
原著論文:LRRC59 Regulates Trafficking of Nucleic Acid-Sensing TLRs from the Endoplasmic Reticulum via Association with UNC93B1 (The Journal of Immunology 195:4933-4942, 2015)
更新日:2015年12月28日
概要
核酸を認識するパターン認識受容体であるToll-like receptor(TLR)3,7,8,9は、エンドソームにおいてリガンドを認識してI型インターフェロンの産生をはじめとする自然免疫応答を引き起こす。これらの核酸認識TLRの局在は厳密に制御されており、Uncoordinated 93 homolog B1(UNC93B1)がその制御において重要な分子であることが知られている。本研究では、小胞体に局在する膜タンパク質であるLeucine-rich repeat containing protein(LRRC)59が、核酸認識TLRがUNC93B1を介して小胞体から輸送される過程において機能することを明らかとした。
背景
TLRには細胞膜で活性化するものとエンドソームで活性化するものがあり、エンドソームに局在するTLR3,7,8,9は、いずれも核酸をリガンドとして認識して活性化する(1)。自己由来の核酸に対する応答を避け、細胞外より取り込まれた外来の核酸のみを認識するためには、核酸認識TLRの局在制御は極めて重要である。
近年、TLR3,7,8,9は小胞体においてUNC93B1をはじめとする複数のシャペロン分子の機能を介してフォールディングおよび輸送が制御され、エンドソームではカテプシンなどによる切断を受けて活性化することが報告されている。生合成されたTLR3,7,8,9はCOPII小胞輸送により、UNC93B1依存的に小胞体から出てゴルジ体/エンドソームへと輸送される (2-5)。特にTLR7および9においては、定常状態では小胞体に貯留されており刺激依存的にエンドソームへ移行することが知られている (6,7)。
LRRC59は、核膜および小胞体に局在するII型1回膜貫通タンパク質であり、これまで、小胞体におけるLRRC59の機能は報告されていなかった。本研究では、LRRC59が核酸認識TLRの局在制御に関与することを示した(8)。
LRRC59のノックダウンにより、核酸認識TLRによるシグナル伝達は阻害される
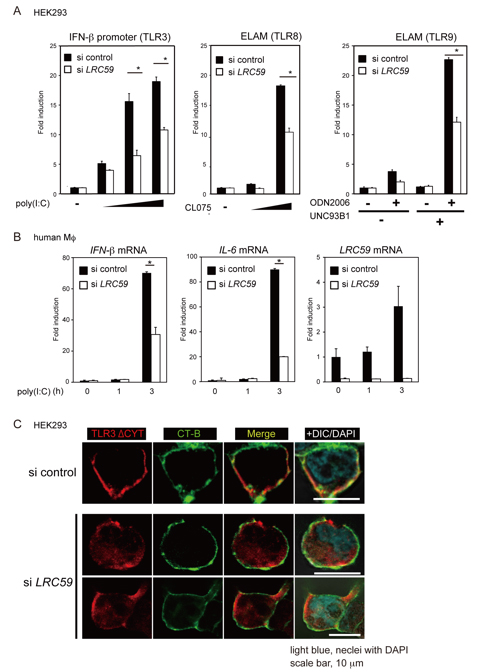
TLR3を強制発現させたHEK293細胞において、siRNAを用いてLRRC59をノックダウン(si LRC59)したところ、二本鎖RNA合成アナログであるpoly(I:C)刺激によるIFN-βプロモータの活性化が抑制された (図1A)。同様に、TLR8および9を発現させた細胞においてLRRC59をノックダウンしたところ、CL075(TLR8 リガンド)およびODN2006(TLR9 リガンド)で刺激した時のELAM活性が抑制された (図1A)。また、ヒト単球由来マクロファージ(human MΦ)においてLRRC59をノックダウンすると、poly(I:C)刺激後の内在性TLR3を介したIFN-βおよびIL-6のmRNA誘導が減弱した (図1B)。
同様にしてTLR4リガンドであるLPSによってTLR4を介したNF-κBの活性化を調べたところ、LRRC59のノックダウンによる影響は見られなかった。これらのことから、LRRC59は、核酸認識TLR特異的にその活性を制御することが明らかとなった。
LRRC59はpoly(I:C)刺激依存的にUNC93B1と相互作用する
HEK293細胞においてLRRC59およびUNC93B1を強制発現させて共免疫沈降を行ったところ、両者は相互作用し、poly(I:C)刺激によりその結合が増強することがわかった。さらに、LRRC59の抗体を用いた共免疫沈降実験により、HEK293細胞の内在性LRRC59とUNC93B1においても同様の結果が確認された。
また、内在性LRRC59と強制発現したUNC93B1の共局在についてHEK293細胞およびHeLa細胞において調べたところ、poly(I:C)刺激依存的に共局在が増強された。この実験では、in situ Proximity Ligation Assayにより定量的に測定を行った。
エンドサイトーシスがLRRC59とUNC93B1の相互作用を引き起こす
poly(I:C)刺激によりLRRC59とUNC93B1との結合が増強されたことから、この増強を引き起こす刺激の特異性を調べるため、各TLRリガンド、CL075 (TLR8 リガンド)、M362 (TLR9 リガンド)、pam2CSK4 (TLR2/6 リガンド)、LPS (TLR4 リガンド)による刺激を与え相互作用を調べた。
その結果、これらすべての刺激によりLRRC59とUNC93B1の結合の増強が見られた。TLR4を刺激した時にも結合増強が見られたことから、必ずしもLRRC59が関与すると考えられる核酸認識TLRの刺激でなくてもLRRC59とUNC93B1の結合が促されることがわかった。このことは、LPS刺激によってもTLR7のエンドソーム移行が引き起こされるという報告とも合致する (4)。
エンドサイトーシス自体がその引き金となる可能性が考えられたため、TLRリガンド以外にもポリスチレンビーズやOVAを細胞外から与えて細胞内へエンドサイトーシスによって取り込ませたところ、同様の結合増強が観察された。このことから、TLR刺激に関わらず、エンドサイトーシスが起こることで、LRRC59とUNC93B1との結合が促進されることが明らかとなった。また、サイトカラシンD処理によりエンドサイトーシスを阻害すると、poly(I:C)刺激およびLPS刺激を行っても両分子の結合は増強されないことを確認した。
LRRC59はTLR3の小胞体からエンドソームへの移行を促進する
HeLa細胞において、内在性のTLR3はエンドソームマーカーであるEarly endosome Ag 1(EEA1)と部分的に共局在している。LRRC59をノックダウンしたところ、TLR3のエンドソーム局在が減少した。しかしながら、TLR3とEEA1の共局在は部分的であり観察が容易ではない。そこでより明確に観察するため、細胞表面に局在するTLR3変異体であるTLR3ΔCYTを利用した。TLR3ΔCYTは細胞内局在化に重要な細胞質領域を欠いており、小胞体から出るとエンドソームではなく細胞表面に発現するため、細胞表面マーカーであるコレラ毒素Bサブユニット(CT-B) と共局在する。LRRC59をノックダウンしたところ、強制発現したTLR3ΔCYTはCT-Bと共局在せず、小胞体に留まる様子が観察された (図1C)。つまり、LRRC59のノックダウンによりTLR3ΔCYTは小胞体からの輸送を阻害されたと考えられる。
さらに、TLR3ΔCYTと内在性のUNC93B1およびLRRC59の共局在をそれぞれ観察したところ、UNC93B1はTLR3ΔCYTと細胞表面で共局在したが、LRRC59は細胞内にとどまっており共局在は見られなかった。したがって、UNC93B1はTLR3と共に小胞体から出るが、LRRC59分子自身は小胞体に留まったままTLR3の輸送を助けることがわかった。
総括
核酸認識TLR (TLR3,7,8,9)の局在は、外来の微生物由来核酸に対して適切に防御応答を引き起こすために厳密に制御される必要がある。
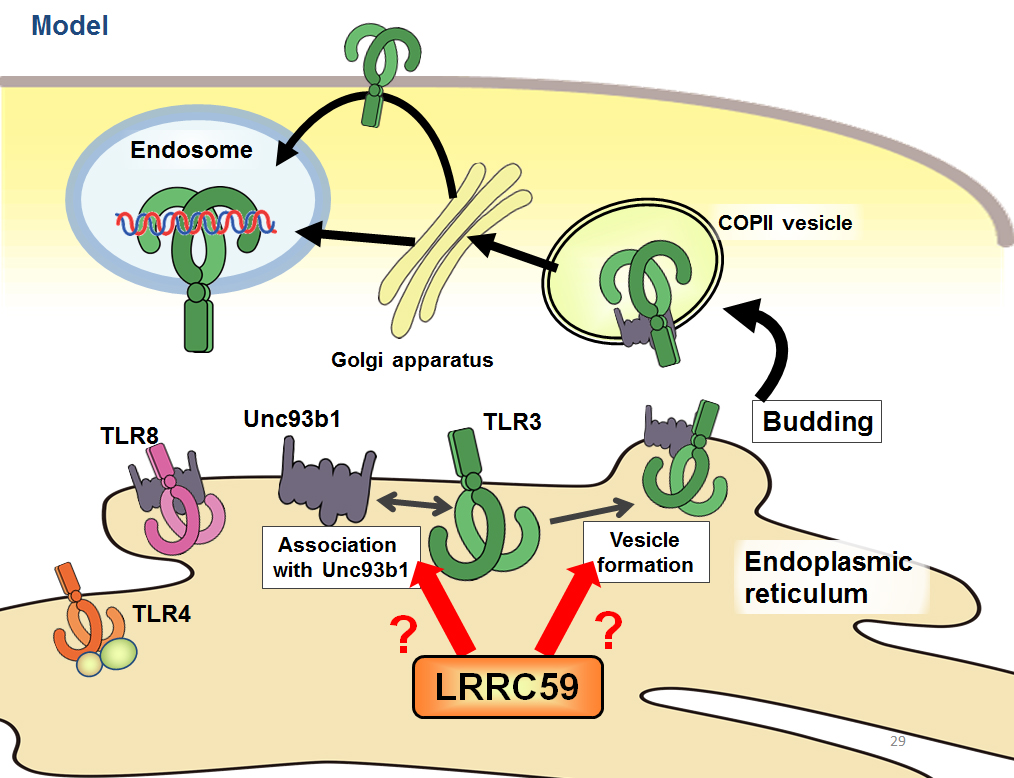
本研究の結果から、ウイルス感染時などに細胞がエンドサイトーシスを介して細胞外から物質を取り込むと、小胞体においてLRRC59とUNC93B1が相互作用し、このことが核酸認識TLRの輸送に寄与してウイルス感染応答を正に制御するというモデルが想定される。このとき、LRRC59がUNC93B1と相互作用することでUNC93B1と核酸認識TLRの結合が促進される可能性と、COPII小胞の形成が促進される可能性が考えられる (図2)。
本研究は、核膜および小胞体膜に局在するLRRC59について、未知であった小胞体における機能を報告するものであり、核酸認識TLRの細胞内輸送制御機構について新たな知見を示した。エンドサイトーシスからどのようなシグナル伝達を介してLRRC59とUNC93B1が結合するのか、また、核酸認識TLRがどのような機構により小胞体からCOPII小胞に乗せられるのかなど不明な点が残されており、詳細な解析が待たれる。
参考文献
1. Barton, G. M., and J. C. Kagan. 2009. A cell biological view of Toll-like receptor function: regulation through compartmentalization. Nat. Rev. Immunol. 9: 535-542.
2. Tabeta, K., K. Hoebe, E. M. Janssen, X. Du, P. Georgel, K. Crozat, S. Mudd, N. Mann, S. Sovath, J. Goode, et al. 2006. The Unc93b1 mutation 3d disrupts exogenous antigen presentation and signaling via Toll-like receptors 3, 7 and 9. Nat. Immunol. 7: 156-164.
3. Brinkmann, M. M., E. Spooner, K. Hoebe, B. Beutler, H. L. Ploegh, and Y. M. Kim. 2007. The interaction between the ER membrane protein UNC93B and TLR3, 7, and 9 is crucial for TLR signaling. J. Cell Biol. 177: 265-275.
4. Kim, Y. M., M. M. Brinkmann, M. E. Paquet, and H. L. Ploegh. 2008. UNC93B1 delivers nucleotide-sensing toll-like receptors to endolysosomes. Nature 452: 234-238.
5. Itoh, H., M. Tatematsu, A. Watanabe, K. Iwano, K. Funami, T. Seya, and M. Matsumoto. 2011. UNC93B1 physically associates with human TLR8 and regulates TLR8-mediated signaling. PLoS One 6: e28500.
6. Latz, E., A. Schoenemeyer, A. Visintin, K. A. Fitzgerald, B. G. Monks, C. F. Knetter, E. Lien, N. J. Nilsen, T. Espevik, and D. T. Golenbock. 2004. TLR9 signals after translocating from the ER to CpG DNA in the lysosome. Nat. Immunol. 5: 190-198.
7. Leifer, C. A., M. N. Kennedy, A. Mazzoni, C. Lee, M. J. Kruhlak, and D. M. Segal. 2004. TLR9 is localized in the endoplasmic reticulum prior to stimulation. J. Immunol. 173: 1179-1183.
8. Tatematsu, M., K. Funami, N. Ishii, T. Seya, C. Obuse, and M. Matsumoto. 2015. LRRC59 regulates trafficking of nucleic acid-sensing TLRs from the ER via association with UNC93B1. J Immunol. 195: 4933-4942.