胸腺髄質、それはAireの機能的な場を提供する
Tweet執筆者情報
執筆者:西嶋仁、松本満
執筆者所属:徳島大学疾患酵素学研究センター・免疫病態研究部門
原著論文:Ectopic Aire Expression in the Thymic Cortex Reveals Inherent Properties of Aire as a Tolerogenic Factor within the Medulla. (The Journal of Immunology 195: 4641-4649, 2015)
更新日:2016年1月29日
概要
胸腺は、T細胞が自己寛容性と非自己への応答性を確立するのに重要な器官であり、胸腺髄質と皮質から構成されている。我々は、胸腺髄質上皮細胞(medullary thymic epithelial cell: mTEC)で発現しているAire(autoimmune regulator)を胸腺皮質上皮細胞(cortical TEC: cTEC)に発現させたマウスを作出して、Aireの機能がcTECにおいても発揮されるかどうかを検討した。Aireを発現させたcTECでは組織特異的遺伝子群は誘導されず、内在性Aireを相補しなかったため、Aireの機能的な場としての髄質の独自性が示された。
はじめに
獲得免疫系は自己と非自己を識別し、非自己のみを攻撃する生体防御システムであり、中心的役割を担うリンパ球がT細胞である。自己と非自己を識別するためのT細胞抗原受容体(TCR)のレパトアは、胸腺皮質における正の選択と、それに続く胸腺髄質における負の選択によって形成される。
自己組織に対して免疫担当細胞が攻撃しないシステムが自己寛容であり、その破綻は自己免疫疾患をもたらす。胸腺では遺伝子再編成により様々なTCRを持つT細胞が作出されうるが、自己組織と反応するTCRを持つT細胞の大部分は胸腺における負の選択で除去されるか、制御性T細胞に分化誘導されると考えられている(中枢性自己寛容)。中枢性自己寛容が成立するメカニズムは、mTECが様々な末梢組織に特異的なタンパク質群を発現することによって可能となる[1]。これらの組織特異的自己抗原が、mTECや樹状細胞の主要組織適合遺伝子複合体(MHC)分子によって提示され、それを抗原として認識するT細胞が除去される。mTECにおいて組織特異的遺伝子群の発現を制御している中心的な転写調節因子がAireである。Aire遺伝子はヒトの遺伝性自己免疫疾患である自己免疫性多腺性内分泌疾患I型の原因遺伝子として同定された経緯を持つ[2] 。Aire遺伝子をノックアウトしたマウスでは、組織特異的遺伝子群の胸腺内の発現低下と自己免疫疾患の病態が観察された[3]。これまでの報告から、Aireの免疫学的機能は種を超えて保存されており、自己寛容成立における重要性が示されている。
AireをcTECで異所性に発現させる
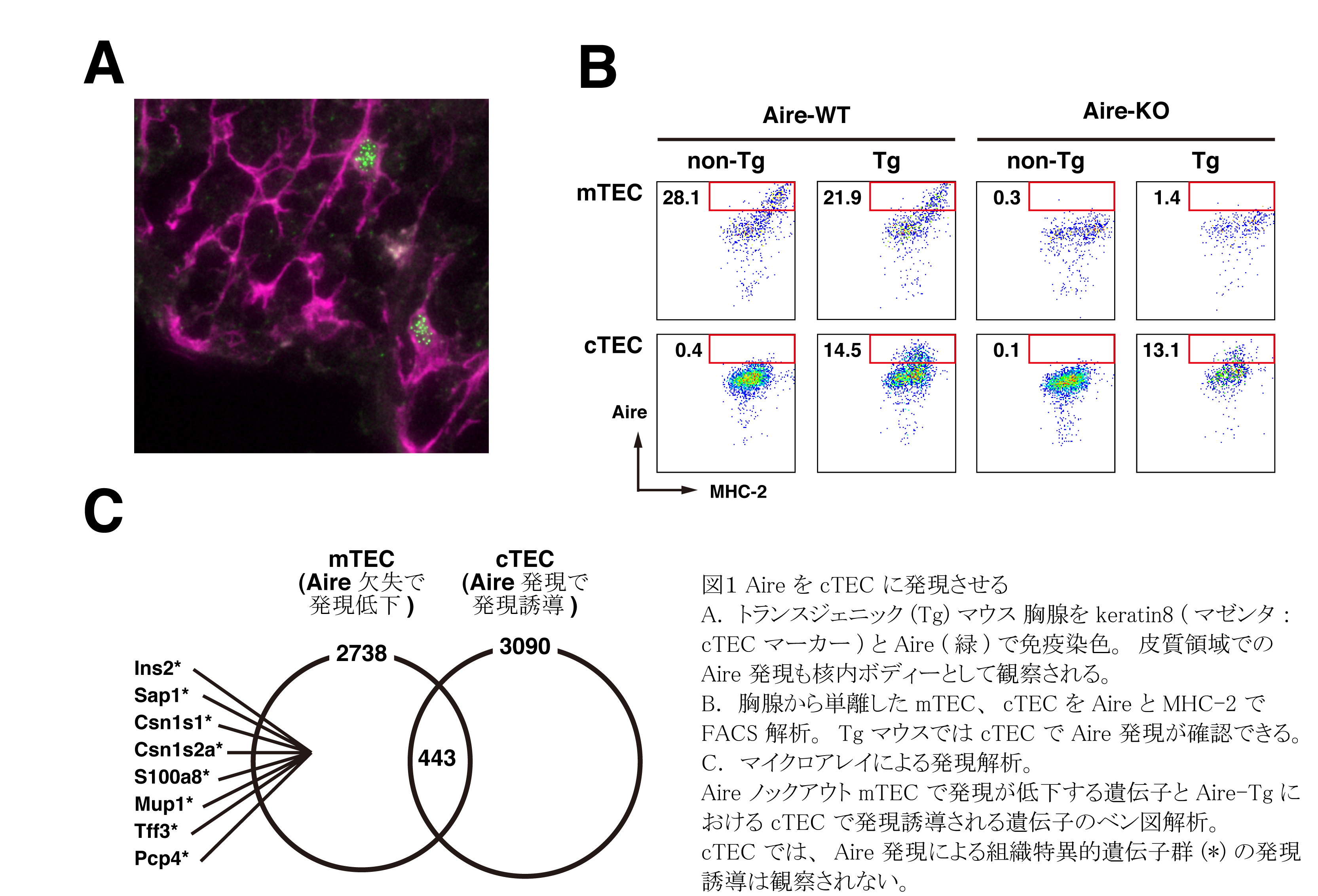
mTECとcTECは共通の前駆細胞から分化するが、cTECに特異的に発現する因子としてβ5tがあり、胸腺皮質における正の選択に寄与している[4]。我々は大腸菌人工染色体 (BAC)上のβ5t遺伝子の開始コドンのメチオニンをマウスAireコーディング領域に組換えたBACベクターを作製し、NODマウス受精卵に導入してβ5t/Aireトランスジェニックマウスを作出した。さらに、このマウスと内在性Aireノックアウトマウスと交配する事によって、Aireの発現部位がそれぞれ異なる4種類のマウスを樹立した(図1A, B):mTECでAireが発現する野生型マウス、Aireノックアウトマウス、mTECとcTECの両方でAireが発現するマウス、cTECのみで発現するマウス。cTECで発現したAireは、mTECにおけるAireと同様に核内ボディーを形成しており、Aireの核内における構造的特質は維持されていた。しかし、β5tがcTECの大部分の細胞で発現するにも関わらず、フローサイトメーターによって定量的に検出したAire発現cTECは10%程度であったため(図1B)、cTECの一部にのみAireタンパク質を維持できる機構が備わっているか、あるいはAireタンパク質を積極的に排除する機構が備わっていると考えられる。Aire発現が細胞の生死に関与するのかという点については議論が続いているが[5]、AireをcTECに発現させてもcTEC数は野生型マウスと違いがなく、Aireが積極的にアポトーシスを誘導することはcTECでは観察されなかった。
Aire依存的遺伝子は細胞種によって異なる
AireはmTECにおいて組織特異的遺伝子群の発現を制御しており、Aireノックアウトマウスではそれら遺伝子群の発現低下が観察される。Aireを発現させたcTECにおいても組織特異的遺伝子群の発現が誘導されるかどうかを検討した。胸腺に酵素処理をして分離した細胞からcTEC(CD45-EpCAM+Ly51+UEA-1-)、及び、mTEC(CD45-EpCAM+Ly51-UEA-1+)分画を単離して、各細胞集団のRT-qPCRを行った。mTECではAireノックアウトによりIns2とSap1の発現が低下するが(Aire依存的遺伝子)、Aire発現cTECにおいて両遺伝子の発現は誘導されなかった。また、Aire依存性を示さずにmTECで発現するCRPについても、Aire発現cTECではその発現が誘導されなかった。さらに、マイクロアレイを用いたトランスクリプトーム解析(図1C)においても、Aire依存的遺伝子群の発現はAire発現cTECでは観察されなかった。この事実は、Aireの機能が単に組織特異的遺伝子群の発現を誘導するのではなく、また、Aireによって発現が誘導される遺伝子は細胞種によって異なることを示唆している。一方で、Aireが組織特異的遺伝子群の発現を誘導するためには、mTECがその機能を発揮させるのに有効な場を提供することが示唆された。
mTECでAire依存性を示す2,738遺伝子(Aireノックアウトで発現低下)と、cTECでAire依存性を示す3,090遺伝子(トランスジェニックで発現上昇)を選別した結果、そのうち443遺伝子がmTECとcTECの両方でAireのターゲットとなりうることが示唆された。しかし、有為に濃縮されている生物学的機能は観察されなかった。
正の選択への影響
分化途上の未成熟T細胞は、胸腺ストロマ細胞から様々なシグナルを受取ってその運命が決定される。胸腺皮質ではcTECによって自己抗原ペプチドとMHC複合体が提示され、適度に反応するTCRをもつT細胞だけが正の選択を受けて生存する。AireをcTECで発現させることによりcTECにおける遺伝子発現に変化が認められたため、我々はAireトランスジェニックマウスの正の選択への影響を調べた。CD4及びCD8 T細胞ともに、TCR Vα鎖及びVβ鎖のサブファミリー使用頻度に有為な差は観察されなかった。同様に、γδT細胞においてもcTECにおけるAire発現の影響は観察されなかった。
H-Y抗原(Y染色体上のオス特異的分子由来のペプチド)を認識するHY-TCRトランスジェニックマウスを用いた解析でも、H-2Dbを発現するメスのHY-TCRトランスジェニックT細胞はcTECにおけるAire発現の有無にかかわらず、正の選択を受けて成熟T細胞に分化した。
自己免疫病態への影響
1型糖尿病は、T細胞がインシュリン産生細胞を攻撃することによって起こる自己免疫疾患である。MHC class IIの変異がリスクアレルであり、主要な遺伝的要因である。NODマウスは、ヒトの1型糖尿病関連遺伝的多型MHC class IIと類似した変異を持ち、30週程度で高頻度に糖尿病を発症する。我々はcTECにAireを発現させることによって糖尿病発症を軽減できるかを検討したが、改善を認めなかった。
AireノックアウトNODマウスは重篤な自己免疫疾患症状を示し、著明な生育障害を認め、20週を超えて生存するマウスはほとんどいない。病理学的解析では、NODマウス本来の病原部位である膵臓ラ氏島炎に替わり腺房への免疫細胞浸潤が認められる[6]。我々はcTECにAireを発現させる事によってAire欠損の表現型を改善することができるかを検討したが、AireノックアウトNOD同様、膵臓腺房、肺、胃、甲状腺等に免疫細胞の浸潤が観察され、mTECにおける内在性Aireの機能相補は観察されなかった。
おわりに
mTECとcTECは類縁な細胞であるが、 本研究により自己寛容性に関わるAireの機能を発揮できるのはmTECにおいてのみであることが判明した。その理由として2つの可能性が考えられる。一つは、mTECとcTECではゲノムにマーキングされたエピジェネティクスが異なっている可能性であり、もう一つは、組織特異的遺伝子群の発現などの自己寛容性に関わる機能をAireに付随させる因子がcTECでは欠失している可能性である。後者に関しては、我々はAireがmTECの分化状態を制御している可能性を指摘しているが[7]、最近Aireと協調的に機能する分子候補としてmTECに特異的に発現するSirt1[8]が報告されており、Aireの翻訳後修飾の重要性が示唆されている。Aire機能の全貌を理解するには結合因子群を同定することが必須であり、また、mTECとcTECとのエピジェネティクスの違いを明らかにすることも必要と思われる。
参考文献
1. Anderson, M.S., et al., Projection of an immunological self shadow within the thymus by the aire protein. Science, 2002. 298(5597): p. 1395-401.
2. Nagamine, K., et al., Positional cloning of the APECED gene. Nat Genet, 1997. 17(4): p. 393-8.
3. Kuroda, N., et al., Development of autoimmunity against transcriptionally unrepressed target antigen in the thymus of Aire-deficient mice. J Immunol, 2005. 174(4): p. 1862-70.
4. Ohigashi, I., et al., Aire-expressing thymic medullary epithelial cells originate from beta 5t-expressing progenitor cells. Proceedings of the National Academy of Sciences of the United States of America, 2013. 110(24): p. 9885-9890.
5. Nishikawa, Y., et al., Temporal Lineage Tracing of Aire-Expressing Cells Reveals a Requirement for Aire in Their Maturation Program. Journal of Immunology, 2014. 192(6): p. 2585-2592.
6. Niki, S., et al., Alteration of intra-pancreatic target-organ specificity by abrogation of Aire in NOD mice. J Clin Invest, 2006. 116(5): p. 1292-301.
7. Yano, M., et al., Aire controls the differentiation program of thymic epithelial cells in the medulla for the establishment of self-tolerance. J Exp Med, 2008. 205(12): p. 2827-38.
8. Chuprin, A., et al., The deacetylase Sirt1 is an essential regulator of Aire-mediated induction of central immunological tolerance. Nature Immunology, 2015. 16(7): p. 737-745.