線維芽細胞増殖因子と血管内皮細胞増殖因子により心筋ダイレクト・リプログラミングを促進する
Tweet執筆者情報
執筆者:山川裕之、家田真樹
執筆者所属:慶應義塾大学 循環器内科
原著論文:Fibroblast Growth Factors and Vascular Endothelial Growth Factor Promote Cardiac Reprogramming under Defined Conditions. (Stem Cell Reports 5:1128-1142, 2015)
更新日:2016年2月16日
概要
Gata4、Mef2c、Tbx5(各頭文字をとってGMT)を始めとした心臓特異的な転写因子群、もしくはmicro-RNA群を線維芽細胞に導入することで、iPS細胞を介さない心筋様細胞(iCM細胞, induced cardiomyocytes)を誘導できることが報告されている。本稿では培養条件を検討し、無血清培地にfibroblast growth factor(FGF)2、FGF10、vascular endothelial growth factor(VEGF)(各頭文字をとってFFV)を加えることで、自律拍動を有するiCM細胞を従来法と比べて100倍得ることができた。心筋ダイレクト・リプログラミングの過程でFFVを加えることで、p38 mitogen-activated protein kinase(p38 MAPK)およびphosphoinositol 3-kinase(PI3K)/AKT経路を介し心筋誘導を促進していることが考えられた。さらに、FFV添加培地ではGata4を必要とせず、Mef2cとTbx5のみで心筋リプログラミングを可能にした。
背景
近年、iPS細胞を介さずに様々な細胞が誘導され、新たな再生医療の細胞源として注目されている。その中で、GMTを始めとした心臓特異的な転写因子群やmicro-RNA群を線維芽細胞に導入することで、iCM細胞を誘導できることが報告されている (1)。しかし、自律拍動を有する「フル・リプログラム」されたiCM細胞への誘導効率は0.1%程度であり、臨床応用面では不十分である。
2010年に家田らがiCM細胞を発見 (2) 以降、Hand2 (3)やNkx2-5などの心筋特異的転写因子を導入することで心筋リプログラミングの効率を改善できることが報告されてきた。一方で、培養条件を変えることで心筋リプログラミングの効率を向上させた報告はない。
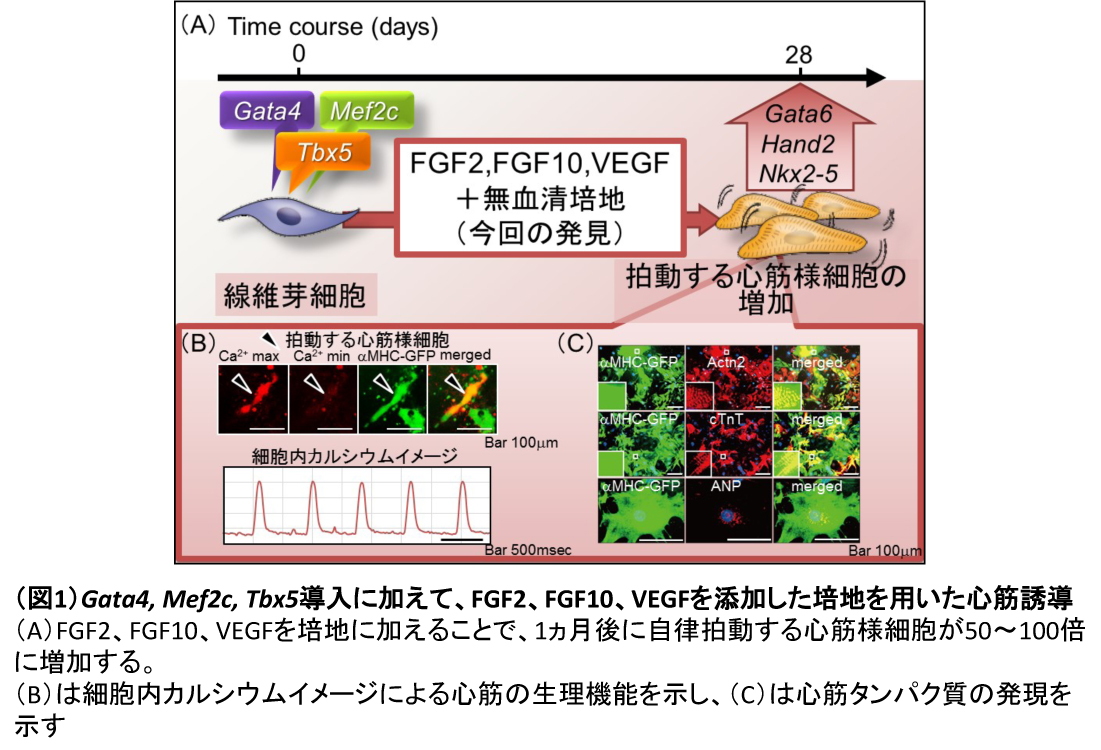
FFVによって自律拍動を有するiCM細胞を効果的に得ることができる(図 1)
家田らはiCM細胞の誘導効率を調べる際に、GMT遺伝子導入1週間後に心臓特異的リポーターであるαMHC promoter-driven GFP(αMHC-GFP)を導入したマウスを使用した (2)。しかし、この方法では機能的なiCM細胞を誘導することと一致しないと考えられた。そこで本研究では、4週間後に自律拍動を有するiCM細胞を数える方法を考案した。
胎児培養線維芽細胞(MEF, mouse embryonic fibroblasts)をセルソースとして、ES/iPS細胞から心筋分化に使用する8つの小分子とサイトカイン (4), (5)を無血清培地(SF, serum free)に添加して培養し、自律拍動を有するiCM細胞を数えた。また、対照として従来の条件であるDMEM/M199/10%ウシ胎児血清(FBS, fetal bovine serum)を用いて培養 (2), (6)した。
スクリーニングの結果から、SF培地にFGF2、FGF10、VEGFを各々加え培養すると、自律拍動するiCM細胞数が優位に増加した。さらに、FGF2、FGF10、VEGFを全て加えた培地では、従来法と比べて50~100倍の拍動するiCM細胞を得た。FFVで培養したiCM細胞はCa2+トランジェントを示し、免疫染色にて明瞭なサルコメア構造を持つ心筋特異的タンパク質も確認できた。
FFVはp38MAPKとPI3K/AKT経路を介して心筋のフル・リプログラミングを促進し、機能的なiCM細胞を誘導する
通常、GMTを遺伝子導入すると、機能的なiCM細胞は4週間で発現する。FFV添加培地を用いて、その期間内に自律拍動を有するiCM細胞を誘導するために最適な培養条件を検討した。
遺伝子導入後初めの2週間はFBSで、3週目からFFVを添加した培地で培養すると効率的な自律拍動iCM細胞を得ることができた。時系列で見ると心筋前駆細胞マーカーであるMesp1やIsl1などの転写因子遺伝子発現の変化はなく、EdUアッセイでもFFV培養下で自己増殖しないことが示された。また、心臓ペースメーカーの遺伝子であるHCN4の発現を認めなかった。結果として、ダイレクト・リプログラミングの過程において、未熟なiCMがFFV添加培地によりフル・リプログラミングが推進され、自律拍動を有するiCM細胞が増加すると考えられた。
FFV培養によりiCM細胞が自律拍動を有するフル・リプログラミングを誘導するメカニズムを探索した。マイクロアレイ解析によりFFV培養したiCM細胞の遺伝子発現の変化を、GMT遺伝子導入後、2週間後(自律拍動する前のiCM細胞:前期リプログラミング)、4週間後(自律拍動が認められるiCM細胞:後期リプログラミング)と経時的に調べた。
4週間FFV培養したiCM細胞において発現が増加した遺伝子をGO term解析した結果、心筋収縮に関連する遺伝子群だけでなく、イオンチャネルやカルシウム・ホメオスタシスを調整する遺伝子群などの心筋機能を向上させる遺伝子が増加していた。
実際に、FFV培養したiCM細胞の遺伝子発現をqRT-PCRで調べると、転写制御因子(Gata6、Hand2、Nkx2-5)、心筋サルコメア関連遺伝子(Actn2、Myh6など)、そしてイオンチャネル遺伝子(Kcnq1、Ryr2など)の発現が増加していた。よってFFVがiCM細胞の機能を亢進させることが分かった。
FGFとVEGFが活性化する経路としては、MEK、p38MAPK、PI3K/AKT経路が知られている。FFV培養にSB203580(p38MAPK阻害剤)とLY294002(PI3K阻害剤)を加えると、自律拍動するiCM細胞が抑制され、心筋関連遺伝子の発現も抑制された。よって、iCM細胞をフル・リプログラミングする場合、p38MAPKとPI3K/AKT経路が重要であると考えられた。
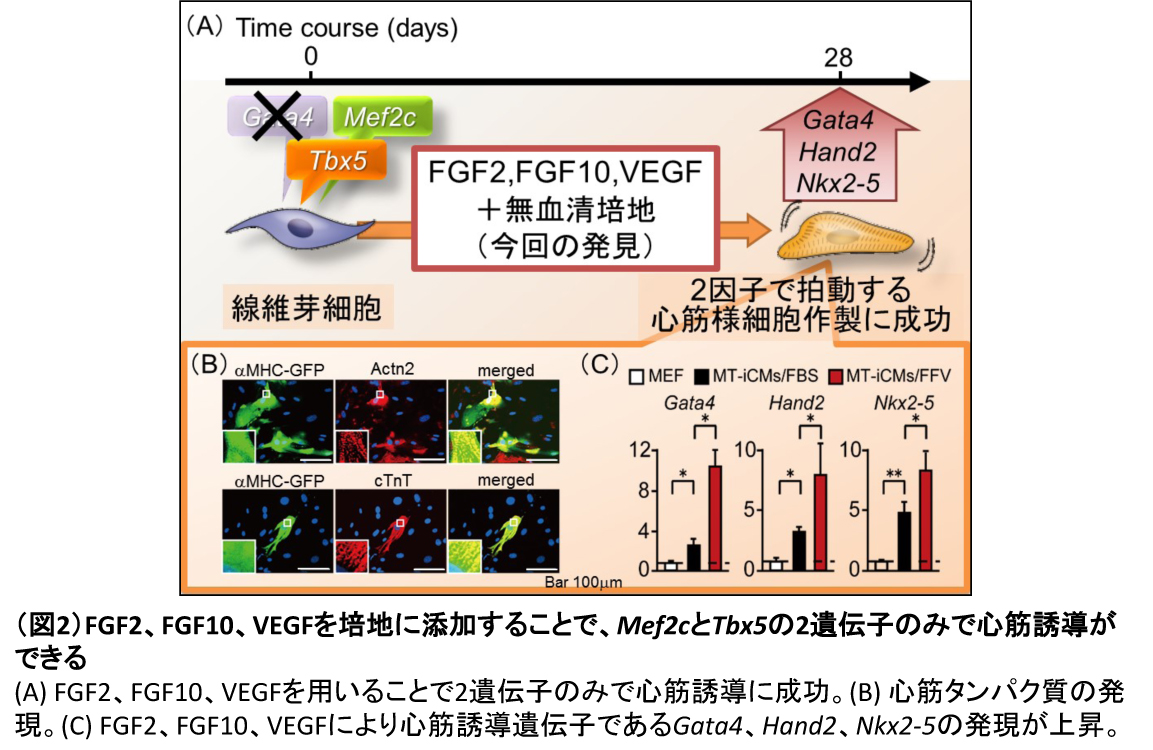
FFVはMef2cとTbx5のみで線維芽細胞からの心筋ダイレクト・リプログラミングを可能にした(図 2)
今までは機能的なiCM細胞を得るためには少なくとも3つの転写因子(GMT)が必要であると考えられていたが、FFV培養下では転写因子を減らすことが可能ではないかと考えた。結果として、FFV培養では、Mef2cとTbx5(MT)の2因子のみでも自律拍動を有するiCM細胞が得られた(MT-iCM細胞)。
FFV培養したMT-iCM細胞はCa2+トランジェントを示し、心筋特異的タンパク質も確認できた。また、FFVとFBSのそれぞれで培養したMT-iCM細胞の遺伝子発現を比較すると、前者ではGata4だけでなく、Hand2、Nkx2-5を含む心臓特異的転写因子の発現が増加していることが分かった。
マイクロアレイを用いてMT-iCM細胞の網羅的な遺伝子発現を調べると、GMTから誘導したiCM細胞(GMT-iCM細胞)に近い遺伝子発現パターンが得られた。また、心筋特異的遺伝子の発現が増加していた一方で、骨格筋や平滑筋細胞に特異的な遺伝子の発現を誘導しなかった。
以上の結果から、FFV培養によって、MT-iCM細胞ではGata4を含む心筋特異的遺伝子の発現が増加し、Mef2c、Tbx5の2つの転写因子だけで心筋リプログラミングが可能となった。
FFVはマウス尾部線維芽細胞の心臓リプログラミングをも可能にする
GMTにHand2を加えて遺伝子導入し (3)、3週目からFFV培養すると、最大9%の機能を有するiCM細胞を得ることができた(GHMT-iCM細胞)。さらに、GHMT-iCM細胞は心筋細胞シートのように収縮することもあった。この結果は、GMTだけではなく、FFV培養は3週目以降の後期リプログラミングを促進していると考えられた。
MEFの心筋前駆細胞(CPC, Cardiac Progenitor Cell)の混入を完全になくすために、マウス尾部線維芽細胞をセルソースとして実験を行った。心筋リプログラミング因子として、GMT、GMTに Hand2を加えたもの (3)、GMTにMesp1とMyocdを加えた (7) もの(GMTMM-iCM細胞)を用いて、フル・リプログラミングを有する拍動iCM細胞の誘導を調べた。
全ての心筋リプログラミング因子において、FFV培養下では拍動するiCM細胞を多く得ることができた。FFV培養したGMTMM-iCM細胞において網羅的な遺伝子解析をした結果、心臓機能や心臓発生に必要な遺伝子群の発現が増加していた。遺伝子発現を個別に調べると、Gata6、Hand2、Nkx2-5を含む心臓関連遺伝子の発現増加が認められた。
よって、FFV培養ではセルソースに関係なく、また、心筋リプログラミング因子にも関係なく、自律拍動を有するiCM細胞を誘導できることが示唆された。
総括
我々は、本研究で2つの研究成果を挙げた。
まず、FFV培養は後期リプログラミングにおいて未熟なiCM細胞に作用し、自律拍動する機能的なiCM細胞を増加させることで心臓リプログラミングを促進することを見出した。今までの心筋リプログラミングの報告では、例えば、GMTにHand2やNkx2-5を加えることで (1), (3)早期リプログラミングを促進し、心筋構造タンパク質を増やすことでフル・リプログラミングを促進するものであり、煩雑な実験と時間を要した。
我々はまた、p38MAPKとPI3K/AKT経路が重要なシグナリング経路であることを見出した。今までのES/iPS細胞からの心筋誘導の研究においても、P38MAPKおよびPI3K/AKT経路の重要性が指摘されており、同様にiCM細胞の成熟メカニズムを検討することができると考えられた (8)。我々の結果と一致して、Olson E.N.のグループはGHMT-iCM細胞を誘導する際に、AKT1によりラパマイシン複合体1とフォークヘッド型転写因子FoxO3のシグナルを介して心筋リプログラミングが促進されたと報告している (9)。
次に、FFV培養ではMef2cとTbx5の2因子のみで自律拍動するiCM細胞を得ることができた。p38MAPKとPI3K/AKT経路を含む未知の経路を介してFFVがGata4や他の心臓リプログラミング因子を誘導し、結果としてMef2cとTbx5を加えるだけで心臓リプログラミングが可能になったと考えられた。
近年、成長因子がリプログラミングに関与することが報告されている。生体内のプログラミングでは、ラットの心筋梗塞モデルマウスに対し、GMTにVEGFを加えることで心筋梗塞巣を改善させたという報告がある (10)。
我々の研究では、自律拍動するiCM細胞を得るために必須であると考えられてきた因子の数を減らすことに成功したため、今後は遺伝子導入をせず、薬物のみで心筋リプログラミングを促進させることが可能となるかもしれない。
参考文献
1. Sadahiro, T., et al. Direct cardiac reprogramming: progress and challenges in basic biology and clinical applications. Circ. Res, 2015. 116: p.1378-1391.
2. Ieda, M., et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell, 2010. 142: p.375-386.
3. Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature, 2012. 485: p.599-604.
4. Burridge, P.W., et al. Chemically defined generation of human cardiomyocytes. Nat. Methods, 2014. 11: p.855-60.
5. Kattman, S.J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell, 2011. 8: p.228-40.
6. Muraoka, N., et al. MiR-133 promotes cardiac reprogramming by directly repressing Snai1 and silencing fibroblast signatures. EMBO J, 2014. 33: p.1565-81.
7. Wada, R., et al. Induction of human cardiomyocyte-like cells from fibroblasts by defined factors. Proc. Natl. Acad. Sci. USA, 2013. 110: p.12667-72.
8. Naito, A.T., et al. Early stage-specific inhibitions of cardiomyocyte differentiation and expression of Csx/Nkx-2.5 and GATA-4 by phosphatidylinositol 3-kinase inhibitor LY294002. Exp. Cell Res. 2003. 291: p.56-69.
9. Zhou, H., et al. Akt1/protein kinase B enhances transcriptional reprogramming of fibroblasts to functional cardiomyocytes. Proc. Natl. Acad. Sci. USA. 2015.112: p.11864-9.
10. Mathison, M., et al. In vivo cardiac cellular reprogramming efficacy is enhanced by angiogenic preconditioning of the infarcted myocardium with vascular endothelial growth factor. J. Am. Heart Assoc. 1, 2012. e005652.