血中のテオフィリンの簡便な測定を可能とするCEDIA法を用いたマイクロ流体デバイスの開発
Tweet執筆者情報
執筆者:西山慶音1、渡慶次学2
執筆者所属:1北海道大学大学院総合化学院、2北海道大学大学院工学研究院
渡慶次研究室Website:https://labs.eng.hokudai.ac.jp/labo/tokeshi_lab/
原著論文:Development of a microdevice for facile analysis of theophylline in whole blood by a cloned enzyme donor immunoassay. (Lab on a Chip 19:233-240, 2019)
掲載日:2019年2月25日
概要
血中薬物濃度を簡便かつ迅速に測定可能なマイクロ流体デバイスを開発した。検出反応にはイムノアッセイの一種であるCEDIA法を利用した。ピペットの手動操作のみで試料の定量分取が可能なマイクロ流体デバイスを作製し、CEDIA法に必要な試薬を凍結乾燥することでデバイス内に封入した。治療薬物モニタリングのモデル物質として、テオフィリンを用い、全血中のテオフィリン濃度の測定が可能か検証した。その結果、全血検体2 uL、インキュベーション時間4分で全血中のテオフィリン濃度の測定が可能であることを示した。
背景
マイクロ流体デバイスとは、微細加工技術を用いて基板上に微小な流路を作製し、化学分析や化学反応を行うデバイスの総称である。実験室で行う混合や分離、検出などの実験操作を、手のひらサイズのデバイスに集積することが可能であり、様々な分野で応用されている。近年、このマイクロ流体デバイスをポイントオブケア検査(POCT: Point-of-Care Testing)に応用する研究が世界中で行われている[1,2]。POCTとは被験者のベッドサイドで臨床検査を行うことを指し、診断および治療の効率・迅速化に貢献するため、非常に注目を集めている。POCTに用いられる検査手法には、再現性・正確性・高感度・低侵襲性・定量性・適応性・迅速性・小型・簡便性であることが求められる。マイクロ流体デバイスは、これらの条件を達成するのに適した特徴を有している。
POCTを含めた医療診断や、オンサイト環境分析など様々な分野の分析手法として、免疫測定法(Immunoassay)が一般的に用いられている[3]。その中でもCEDIA(Cloned Enzyme Donor Immunoassay)法は、洗浄操作を必要としないため短時間での測定が可能であり、分子量の小さいターゲットの測定に適している特徴を持つ[4,5]。本研究では、CEDIA法を検出原理として用い、迅速かつ簡便に治療薬物モニタリング(TDM: Therapeutic drug monitoring)を実施可能なマイクロ流体デバイスを開発した。TDMのモデル物質として、気管支喘息の治療薬であるテオフィリンを用い、全血中のテオフィリンを測定可能なマイクロ流体デバイスの開発を行った。
CEDIA法について
CEDIA法は、遺伝子工学的に酵素β-ガラクトシダーゼをEnzyme Acceptor(EA)とEnzyme Donor(ED)に分割したものを用いる。これらの断片は水溶液中で自然会合して触媒活性を有する酵素β-ガラクトシダーゼを形成する。EAと相補性を持つ測定対象物質(アナライト)をEDに結合させると、これらもEAと自然会合し活性を持つ酵素を形成することができる。しかし、このED-アナライト結合体中のアナライト部分に抗アナライト抗体が結合すると、EAとの会合が妨げられ、活性を持つ酵素が再形成されなくなる。抗アナライト抗体に対して、検体中のアナライトとED-アナライト結合体は競合的に反応する。その結果、検体中のアナライトの濃度に比例してβ-ガラクトシダーゼの形成量が増加する。本研究で用いた酵素基質であるフルオレセイン ジ-β-D-ガラクトピラノシドは、β-ガラクトシダーゼとの酵素反応により蛍光分子フルオレセインを生成する。このフルオレセインの生成量はβ-ガラクトシダーゼ量に依存するため、アナライト検出に利用することが可能である。
マイクロ流体デバイスの作製
作製したマイクロ流体デバイスを図1に示す。ガラス基板に、マイクロ流路を有したポリジメチルシロキサン(PDMS)チップを張り合わせて作製した。PDMSチップのサンプル導入口には血漿分離膜を組み込み、全血を滴下するだけで血漿成分の分離を可能とした。また、CEDIA法に必要な試薬は、デバイスの試薬封入部に導入して凍結乾燥することで、デバイス内に保存することを可能とした。
マイクロ流路は、幅の広い1本の流路と狭い4本の試薬封入部を組み合わせた設計とした。疎水性材料を流路チップに用いる場合、幅の太い流路と狭い流路を組み合わせることで、圧力障壁により溶液の定量分取が可能となる[6]。この原理により、ピペットで空気を導入するだけで溶液の定量分取が可能になるが、溶液に気泡が混入することがあり、定量分取の再現性に影響を与えることが課題であった。そこで本研究では、疎水性かつ空気透過能を有する材料であるPDMSを流路チップに採用し、液体導入の際に生じる気泡を取り除くことができると考えた。
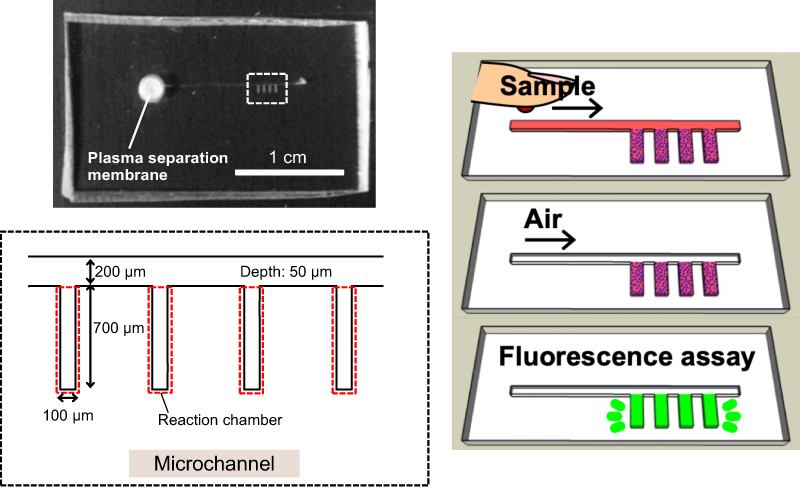
図1: マイクロ流体デバイスおよび測定方法の概略図
(画像クリックで拡大)
マイクロ流体デバイスの性能評価
作製したデバイスの定量分取性能の評価を行った。PDMSチップのサンプルの導入口へ水を滴下し、その後シリンジで空気を導入することで、試薬封入部にのみ水が導入された。このときの試薬封入部を顕微鏡で明視野画像を撮影し、試薬封入部のピクセル数に対する分取した水のピクセル数の誤差(%)を算出することで、定量性を評価した。その結果、分取量の変動係数は1.1%であった。また、4つの試薬封入部の配置箇所による分取量の依存性は見られなかった。以上より、再現性よく溶液を定量分取可能であることが示された。続いて、CEDIA法に用いる試薬を試薬封入部に分取し、凍結乾燥させたのち、血清モデル検体が何秒で導入されるかを検証した。その結果、全てのデバイスにおいて50秒以内で検体の導入が完了した。以上の結果より、本デバイスは再現性良くかつ短時間で溶液を試薬封入部に分取可能であることが明らかとなった。
全血サンプル中のテオフィリン測定
全血サンプル中のテオフィリンを本デバイスで測定可能か検証した。全血サンプルは抗凝固剤などの前処理をせずに、血漿分離膜によって血漿のみを流路内に導入可能なことを確認した。全血サンプル2 uLをCEDIA試薬が封入されたデバイスに滴下し、50秒後にピペットで空気を導入してサンプルを試薬封入部に定量分取した。一定時間インキュベーション後、蛍光顕微鏡で蛍光強度を測定した。図2に作成した検量線を示す。インキュベーション時間とともに、蛍光強度が増加することが分かった。また、濃度増加とともに蛍光強度が増加することが確認された。検出限界はインキュベーション4分で1.23 ug/mL、5分で0.725 ug/mLであった。テオフィリンの治療有効濃度域は5-15 ug/mLであり、インキュベーション時間4分で、テオフィリンをターゲットとしたTDMを実施可能であると判断した。
以上より、迅速かつ簡便に採血直後の全血サンプル中テオフィリンを測定可能なデバイスの開発に成功した。

図2: 全血中テオフィリンの検量線.インキュベーション時間(a)4分、(b)5分
(画像クリックで拡大)
結論
本研究では、TDMのPOCT化を目指し、血中薬物濃度測定を簡便・小型・迅速に行うマイクロデバイスを開発した。検出限界はインキュべーション4分で1.23 ug/mL、5分で0.725 ug/mLであった。この検出限界はテオフィリンのTDMに用いるのには、十分な値である。また、必要な全血モデル検体量は2 uL、インキュベーション時間は4分間であった。最後に、実用化するに当たっては、試薬の保存性の検討が必要である。保存性を高めるためには、トレハロースやスクロースなどの糖を添加するなどの方法が考えられる[7]。また、PDMSの空気透過能の特性を発揮するためには、デバイスを真空パックし保存するなどする必要があると考えられる。
参考文献
[1] L. Kulinsky, Z. Noroozi and M. Madou, Methods Mol. Biol., 2013, 949, 3-23.
[2] K. N. Han, C. A. Li and G. H. Seong, Annu. Rev. Anal. Chem.,2013, 6, 119-141.
[3] The Immunoassay Handbook, ed. D. Wild, Elsevier, Amsterdam, 4th ed, 2013.
[4] D. R. Henderson, S. B. Friedman, J. D. Harris, W. B. Manning and M. A. Zoccoli, Clin. Chem., 1986, 32, 1637-1641.
[5] T. Tachi, N. Kaji, M. Tokeshi and Y. Baba, Anal. Sci., 2009, 25, 149-151.
[6] M. Yamada and M. Seki, Anal. Chem., 2004, 76, 895-899.
[7] X. C. Tang and M. J. Pikal, Pharm. Res., 2005, 22, 1167-1175.

