執筆者自身による研究論文レビュー
Tweet行方和彦、原田高幸
『Dock3はグリコーゲン合成酵素キナーゼ-3β(GSK-3β)による微小管重合を介して視神経軸索の再生を促進する』
更新日:2012年2月17日
原著論文:Dock3 stimulates axonal outgrowth via GSK-3β-mediated microtubule assembly.
The Journal of Neuroscience 32:264-274, 2012.
連絡先:原田高幸
〒156-8506 東京都世田谷区上北沢2-1-6
東京都医学総合研究所 視覚病態プロジェクト プロジェクトリーダー
E-mail: harada-tk@igakuken.or.jp
概要
軸索再生は多くの神経変性疾患において期待される治療法だが、その効率的な誘導には至っていない。我々は神経特異的に発現するグアニンヌクレオチド交換因子であるDock3に注目し、同遺伝子の過剰発現が視神経軸索の伸長を誘導することを見出した。Dock3はアクチン重合に加えて、GSK-3βとの結合を介した微小管の重合を促進するなど、複数の経路を介して軸索伸長に寄与する有力な治療標的であると考えられる。
***
Dockファミリー分子の機能
グアニンヌクレオチド交換因子(guanine nucleotide exchange factor, GEF)はRho ファミリー低分子量Gタンパク質(Rac1, Cdc42, RhoAなど)の活性を制御することにより、細胞内でアクチン細胞骨格の再構築を調節している。たとえばRac1が細胞の先端部で活性化すると、アクチン骨格の重合促進により平板な葉状仮足(ラメリポディア)が形成される。こうした機能は神経細胞でも重要であり、外界からの刺激に応じて細胞骨格を使って形態を変化させることにより、細胞極性や軸索誘導にも関与することが知られている。GEF はこれまでに約80種類が知られているが、以前から良く知られているDouble-homology domain(DH ドメイン)を持つグループと、Dock homology region(DHR)と呼ばれる独自の活性化領域を持つグループに大別される。このうち後者はDock ファミリーとよばれる分子量180-240kDa の分子ファミリーで、これまでに11種類(Dock1~11)が同定されている。このうちDock1(Dock180)はアポトーシス細胞の食作用や筋芽細胞の融合などに重要な役割を持ち、そのシグナルネットワークに関しては国内外の研究者によって比較的多くの研究がなされている(1)。またDock2はリンパ球の走化性に、Dock4の変異は様々な癌の発生や転移に関与することが報告され、Dock familyの生理活性は多岐に渡ることが予想される(2)。
Dock3は神経特異的に発現するGEF
このようなDock familyのうちDock3は別名でModifier of cell adhesion protein(MOCA)と呼ばれ、アルツハイマー病の原因遺伝子産物であるpresenilinに結合する新規タンパク質として発見された。その後Dock3はAmyloid precursor protein(APP)の分解を促進することや、アルツハイマー病患者の脳で減少することが報告されたが、病態との関係は不明のままである(3)。我々はDock3が中枢神経系に特異的に分布し、Rac1を特異的に活性化することを報告した(4)。そこで引き続きDock3を海馬の初代培養細胞に過剰発現させたところ、有意な軸索伸長効果があることを見出した。またDock3による軸索伸長には、強力な神経栄養因子であるbrain-derived neurotrophic factor (BDNF)との相乗効果が確認された(5)。BDNFは脳の発生や学習・記憶といった高次機能にも関与することから、Dock3欠損マウスでは神経軸索の形成不全などが予想される。しかし意外なことにDock3欠損マウスの軸索変性は極めて軽微だった(6)。この原因としては、DHR2領域に存在する活性中心がDock1~4でほぼ共通していることが考えられる(5)。活性中心のアミノ酸配列を変異させたDock3ではRac1活性が大幅に低下し、軸索伸長効果も失われていた。それではDock3による軸索伸長のメカニズムとはどういうものであろうか?
Dock3による軸索伸長のメカニズム
Rac1の下流ではアクチンの重合を促進するWAVE(WASP famiIy verprolin-homologous protein)と呼ばれる蛋白が活性化され、葉状仮足形成を引き起こすことが知られている(7)。研究の過程で我々はDock3が細胞質中でWAVEと複合体を形成し、しかもその結合部位はこれまで十分に機能が解明されていないDHR1領域であることを見出した(図1)。Dock3とWAVE蛋白の複合体はBDNFの刺激によって成長円錐の細胞膜に輸送され、またDock3は細胞膜上でリン酸化を受ける。リン酸化Dock3はRac1の活性を高める一方で、WAVEとの結合能は大きく低下していた。WAVEが細胞膜上でRac1と結合してアクチン繊維を活性化することを考慮すると、Dock3は自らRac1活性を高めるだけでなく、細胞膜近傍にWAVEを供給するというダブル作用で効率良くアクチン繊維の重合と軸索伸長を促進している可能性がある(5)。
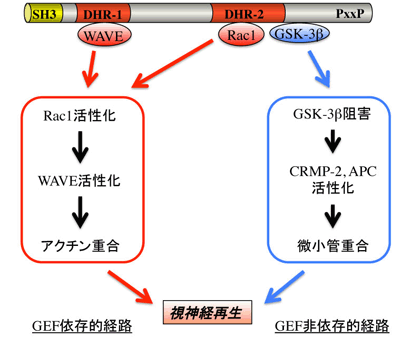
図1 Dock3結合分子と軸索再生のメカニズム
Dock3は異なる部位に結合するタンパク質を使い分けてGEF活性依存的および非依存的経路を駆使することにより、効率良く軸索伸長を促進すると考えられる. SH3, Src homology 3 domain; DHR, Dock homology region; PxxP, SH3 binding motif; WAVE, WASP famiIy verprolin-homologous protein; GSK-3β, glycogen synthase kinase-3β.
一方、グリコーゲン合成酵素キナーゼ-3β(glycogen synthase kinase-3β, GSK-3β)はβ-catenin やタウ蛋白などを含む広範囲にわたるタンパク質をリン酸化するセリン/スレオニンキナーゼであり、糖尿病やアルツハイマー病などへの関与が知られている。しかしGSK-3βは下流のcollapsin response mediator protein-2(CRMP-2)のリン酸化を介して神経極性を制御することが明らかになっており、軸索伸長メカニズムにも寄与することが推定される(8)。我々はDock3がDHR2領域の近傍でGSK-3βと結合し、リン酸化(不活化)を誘導することを明らかにした(図1)。リン酸化GSK-3βはCRMP-2に加えてadenomatous polyposis coli(APC)を活性化し、その結果として微小管の重合を促進したが、Rac1活性には変化を与えなかった(9)。以上からDock3はGEF活性非依存的な経路によっても、細胞骨格の制御が可能であることが示された。
Dock3による軸索再生研究
軸索変性を主要な病態とする疾患の中に、我が国における最大の失明原因である緑内障が存在する。緑内障においては視神経変性とそれに伴う視野障害(見える範囲が狭まる)が問題となっている。一方、視神経変性が始まっても緑内障の進行は極めて緩徐であり、一定期間は網膜神経節細胞の細胞体は正常であると考えられている。したがって細胞体が消失する前に軸索伸長を誘導できれば、新たな治療法につながる可能性がある。そこでDock3の遺伝子過剰発現マウスを作製して視神経損傷実験を行ったところ、野生型マウスよりも視神経の再生が有意に亢進することがわかった(図2)。さらに再生中の視神経軸索にはリン酸化GSK-3βの発現が確認された。
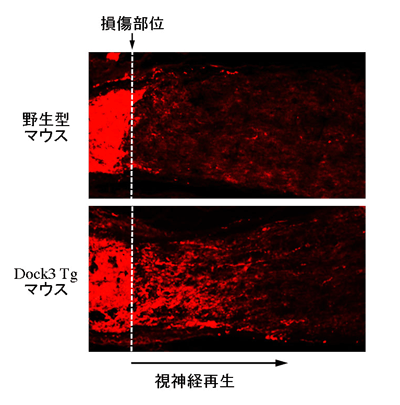
図2 Dock3過剰発現マウスにおける視神経外傷後の軸索再生の亢進
点線は視神経の挫滅部位を示す. GAP43による染色の結果、Dock3過剰発現マウスでは野生型マウスと比較して、有意な軸索再生の促進が観察された.
以上からDock3はGEF活性依存的および非依存的な複数の経路を介して、アクチンと微小管それぞれの細胞骨格を制御するとともに、視神経軸索の伸長に関与することが示された。当研究室では日本の緑内障の7割を占める「正常眼圧緑内障」に関して、世界初の疾患モデル動物を確立している(10)。今後はこのモデル動物に対するDock3の遺伝子治療実験を行い、さらに有効性の検討を進めていく予定である。
***
参考文献
1. Katoh H, Negishi M. RhoG activates Rac1 by direct interaction with the Dock180-binding protein Elmo. Nature 424:461-464, 2003.
2. Co^te´ JF, Vuori K. GEF what? Dock180 and related proteins help Rac to polarize cells in new ways. Trends Cell Biol 17:383-393, 2007.
3. Kashiwa A, Yoshida H, Lee S, Paladino T, Liu Y, Chen Q, Dargusch R, Schubert D, Kimura H. Isolation and characterization of novel presenilin binding protein. J Neurochem 75:109-116, 2000.
4. Namekata K, Enokido Y, Iwasawa K, Kimura H. MOCA induces membrane spreading by activating Rac1. J Biol Chem 279:14331-14337, 2004.
5. Namekata K, Harada C, Taya C, Guo X, Kimura H, Parada LF, Harada T. Dock3 induces axonal outgrowth by stimulating membrane recruitment of the WAVE complex. Proc Natl Acad Sci USA 107:7586-7591, 2010.
6. Chen Q, Peto CA, Shelton GD, Mizisin A, Sawchenko PE, Schubert D. Loss of modifier of cell adhesion reveals a pathway leading to axonal degeneration. J Neurosci 29:118-130, 2009.
7. Takenawa T, Suetsugu S. The WASP-WAVE protein network: connecting the membrane to the cytoskeleton. Nat Rev Mol Cell Biol 8:37-48, 2007.
8. Yoshimura T, Kawano Y, Arimura N, Kawabata S, Kikuchi A, Kaibuchi K. GSK-3β regulates phosphorylation of CRMP-2 and neuronal polarity. Cell 120:137-149, 2005.
9. Namekata K, Harada C, Guo X, Kimura A, Kittaka D, Watanabe H, Harada, T. Dock3 stimulates axonal outgrowth via GSK-3β-mediated microtubule assembly. J Neurosci 32:264-274, 2012.
10. Harada T, Harada C, Nakamura K, Quah HM, Okumura A, Namekata K, Saeki T, Aihara M, Yoshida H, Mitani A, Tanaka K. The potential role of glutamate transporters in the pathogenesis of normal tension glaucoma. J Clin Invest 117:1763-1770, 2007.

