執筆者自身による研究論文レビュー
Tweet東洋一郎1, 2、瀬川将平2、松尾剛明2、西田健太朗2、長澤一樹2
『亜鉛によるミクログリアの活性化における細胞内亜鉛取り込みを介したATP放出およびP2X7受容体活性化の関与』
更新日:2012年3月5日
原著論文:Microglial zinc uptake via zinc transporters induces ATP release and the activation of microglia.
Glia 59:1933-45, 2011.
執筆者所属:1高知大学大学院総合人間自然科学研究科医学専攻(旧 脳神経外科) 〒783-8505高知県南国市岡豊町小蓮、2京都薬科大学生命薬科学系衛生化学分野 〒607-8414京都府京都市山科区御陵中内町5
連絡先:東洋一郎(higasi@kochi-u.ac.jp)、長澤一樹(nagasawa@mb.kyoto-phu.ac.jp)
概要
哺乳類の脳内亜鉛の一部は、神経伝達物質として機能するが、その過剰な分泌は神経細胞死を惹起する。以前著者らは、亜鉛が免疫担当細胞であるミクログリアの活性化因子としての役割も担い、それはNADPH oxidase由来の活性酸素種によるpoly(ADP-ribose) polymerase (PARP)-1の活性化を介したものであることを明らかにした。今回、この亜鉛によるミクログリアの活性化には、そのZIP1による細胞内取り込み、hemichannelsを介したATP放出、そしてオートクライン/パラクライン的なP2X7受容体の活性化が関与することを示した。
***
はじめに
哺乳類の脳内において亜鉛は、神経伝達物質として記憶学習などの脳機能の発現に重要な役割を果たすだけでなく、神経新生などにも関与している。このような亜鉛の一部は、大脳(特に海馬や扁桃体)のグルタミン酸神経細胞の前シナプス小胞内にグルタミン酸と共に貯蔵されており、神経活動に依存してシナプス間隙へ放出される。一方、脳虚血や低血糖脳症などの病態時において、亜鉛はシナプス間隙に過剰に放出され、後シナプス神経細胞に集積することで細胞死を惹起する1,2,3(図1)。
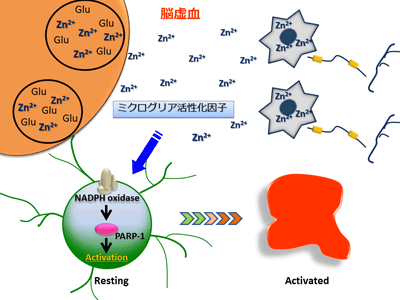
図1. 脳疾患における亜鉛の役割:脳虚血のような病態に陥ると、シナプス間隙へ放出された亜鉛は後シナプス神経細胞に集積して神経細胞死を引き起こすだけでなく、NADPH oxidaseおよびpoly(ADP-ribose) polymerase (PARP)-1の活性化を介してミクログリアの活性化を惹起する。
ミクログリアは脳内免疫担当細胞であり、通常脳内では突起を枝状に伸ばしたrestingミクログリアとよばれる状態でそれぞれテリトリーを持って分布している。このようなrestingミクログリアは単に機能を休止させた細胞ではなく、細胞表面分子を介して異物侵入や脳神経系細胞の機能を監視するなどして脳内環境維持に積極的に寄与することが近年明らかになってきた4, 5。一方、病態時においてミクログリアは活性化され、その形態はアメーバ状に変化し、走化性が誘導され、傷害部位に遊走・集積する。このようなミクログリアはactivatedミクログリアとよばれ、さらにその活性化状態が持続すると、活性酸素種や炎症性サイトカインを過剰に産生・放出するため、傷害部位周囲の正常な神経細胞などにも影響を与える6。これまでミクログリアの活性化機構に関して多くの研究がなされており、その活性化へのヌクレオチドの関与などが報告されているが7、未だ十分に理解されていないのが現状である。
以前著者らは、マウス初代培養restingミクログリアに亜鉛を暴露すると活性化が誘導され、それにはNADPH oxidaseを介した活性酸素種によるpoly(ADP-ribose) polymerase (PARP)-1の活性化が関与することを明らかにした。また、亜鉛をマウス脳内に投与するとミクログリアの活性化が惹起されること、さらに脳虚血モデルマウス脳内に細胞膜非透過型亜鉛キレート剤を投与すると虚血時のミクログリアの活性化が抑制されることも見出した。これらの結果は、シナプス間隙に放出される亜鉛がミクログリア活性化因子として機能することを明確に示している8(図1)。今回著者らは、亜鉛によるミクログリア活性化における亜鉛の暴露からNADPHoxidaseおよびPARP-1活性化までの間に位置する機構について詳細に解析し、得られた知見をGlia (2011)に報告したのでこれを紹介する9。
ミクログリアによる亜鉛取り込みとその活性化
Restingミクログリアに対し、細胞膜透過型亜鉛キレート剤であるTPENまたはBAPTA-AMを亜鉛に特異的とされる濃度で前処置したところ、亜鉛によるミクログリアの形態変化ならびにNADPH oxidaseおよびPARP-1の活性化は抑制された。次に、ミクログリアによる亜鉛取り込み機構を放射標識した亜鉛を用いて精査した。細胞外に亜鉛を添加したところ、37℃において細胞内亜鉛量は反応時間に依存して増加したが、0℃では変化しなかった。また、この取り込みの速度論的解析の結果、ミクログリアによる亜鉛取り込みには少なくとも2つの輸送系が関与することが示された。そこで、細胞内への亜鉛の取り込みに関与することが報告されている亜鉛トランスポータ(ZIPファミリー)およびL-型カルシウムチャネル(LTCC)の寄与について調べた。ミクログリアには細胞膜型ZIP1の発現が認められ、ZIP1の良好な基質阻害剤であるニッケルはミクログリアによる亜鉛取り込みに対してcis-およびtrans-inhibition効果を示した。一方、LTCCの阻害剤であるnimodipineおよびnifedipineはこの亜鉛取り込みに影響を及ぼさなかった。以上の結果から、ミクログリアの細胞外に添加された亜鉛はZIP1を介して細胞内へ取り込まれた後、その活性化を惹起することが示された。
亜鉛処理されたミクログリアからのATP放出とその活性化
ATPはミクログリアの走化性誘導などの活性化に関与するが、それは脳傷害時の神経細胞やアストロサイトからmaxi-anion channelやhemichannel、cystic fibrosis transmembrane conductance regulator(CFTR)などを介して細胞外へ放出される10, 11, 12。近年、ミクログリアにおいてもグルタミン酸刺激によるCFTRを介したATP放出が報告された13。そこで著者らは、亜鉛刺激によってミクログリアからATPが放出されるか否かを検討した。亜鉛添加した後のミクログリア細胞外液中のATP濃度は経時的に上昇し、TPENはこれを抑制した。非選択的hemichannel阻害剤であるcarbenoxoloneは、TPENの場合と同様に、この細胞外ATP濃度の上昇、さらに亜鉛によるミクログリアの形態変化ならびにNADPH oxidaseおよびPARP-1活性化を抑制した。これらの結果は、亜鉛刺激されたミクログリアがhemichannelを介してATPを放出し、その後NADPH oxidaseおよびPARP-1が活性化することによってミクログリアを活性化することを示している。
亜鉛によるミクログリア活性化とP2X7受容体
亜鉛刺激によりミクログリア細胞外へ放出されたATPによるミクログリアの活性化機構を明らかにするため、P2受容体の発現を検討した。マウス初代培養ミクログリアにおいて、P2X1、P2X4、P2X7、P2Y2、P2Y6およびP2Y12受容体が高発現することが確認された。次にこれらP2受容体の亜鉛によるミクログリアの活性化への関与の有無について検討した。その結果、亜鉛によるミクログリアの形態変化ならびにNADPH oxidaseおよびPARP-1の活性化は、P2X7受容体の選択的拮抗剤であるoxATPによって抑制された。またP2X7受容体の特異的刺激剤であるBzATPは、亜鉛の場合と同様にミクログリアの活性化を惹起した。これらの結果から、亜鉛刺激によってミクログリア細胞外へ放出されたATPはオートクライン/パラクライン的にP2X7受容体を活性化することによってNADPH oxidaseおよびPARP-1を活性化し、ミクログリアを活性化することが示された。
まとめ
ミクログリア活性化因子の一つである亜鉛は、ZIP1を介してミクログリア内に取り込まれることでhemichannelを介した細胞外ATP放出を誘導し、オートクラインまたはパラクライン的にP2X7受容体を活性化することで、NADPH oxidaseおよびPARP-1を活性化し、ミクログリアを活性化することが示された(図2)。今回著者らがミクログリア活性化の指標の一つとして用いたその形態変化は走化性に関連する変化であり14, 15、また亜鉛刺激によって細胞外に放出されるATPはミクログリアの走化性を惹起する“find me”シグナルとして認識されていることから16、亜鉛はミクログリアの走化性を制御する因子の一つである可能性が考えられる。この亜鉛によるミクログリアの走化性誘発が、脳傷害時の神経細胞死に対してどのような役割を担うかは不明であるが、その解明はミクログリアを標的とした脳虚血などに対する新しい治療法の開発に繋がるものと期待される。
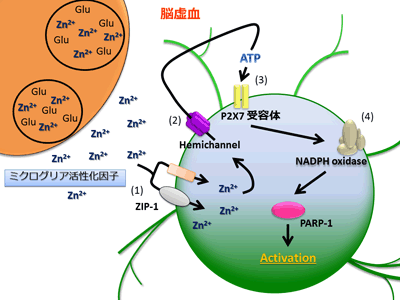
図2. 亜鉛によるミクログリアの活性化機構:(1)亜鉛はZIP1を介してミクログリア内へ取り込まれ、(2)hemichannelを介したATP放出を誘導し、(3)そのATPはオートクライン/パラクライン的にP2X7受容体を活性化することで(4)NADPH oxidaseおよびPARP-1を活性化し、ミクログリアを活性化する。
***
参考文献
1. Assaf SY, Chung SH; 1984, Release of endogenous Zn2+ from brain tissue during activity, Nature, 1984, 308:734-6
2. Koh JY, Suh SW, Gwag BJ, He YY, Hsu CY, Choi DW; The role of zinc in selective neuronal death after transient global cerebral ischemia, Science, 1996, 272:1013-6
3. Suh SW, Garnier P, Aoyama K, Chen Y, Swanson RA; Zinc release contributes to hypoglycemia-induced neuronal death, Neurobiol Dis, 2004, 16:538-45
4. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A; Physiology of microglia, 2011, Physiol Rev, 2011, 91:461-553
5. Nimmerjahn A, Kirchhoff F, Helmchen F; Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo, Science, 2005, 308:1314-8
6. Perry VH, Nicoll JA, Holmes C; Microglia in neurodegenerative disease, Nat Rev Neurol, 2010, 6:193-201
7. Inoue K; Microglial activation by purines and pyrimidines, Glia, 2002, 40:156-63
8. Kauppinen TM, Higashi Y, Suh SW, Escartin C, Nagasawa K, Swanson RA; Zinc triggers microglial activation, J Neurosci, 2008, 28: 5827-35
9. Higashi Y, Segawa S, Matsuo T, Nakamura S, Kikkawa Y, Nishida K, Nagasawa K; Microglial zinc uptake via zinc transporters induces ATP release and the activation of microglia, 2011, 59:1933-45
10. Liu HT, Sabirov RZ, Okada Y; Oxygen-glucose deprivation induces ATP release via maxi-anion channels in astrocytes, 2008, Purinergic Signal. 2008, 4:147-54
11. Schock SC, Leblanc D, Hakim AM, Thompson CS; ATP release by way of connexin 36 hemichannels mediates ischemic tolerance in vivo, Biochem Biophys Res Commun, 2008, 368:138-44
12. Kanno T, Nishizaki T; CFTR mediates noradrenaline-induced ATP efflux from DRG neurons, Mol Pain, 2011, 7:72
13. Liu GJ, Kalous A, Werry EL, Bennett MR; Purine release from spinal cord microglia after elevation of calcium by glutamate, Mol Pharmacol, 2006, 70:851-9
14. Nakajima K, Kohsaka S; Microglia: neuroprotective and neurotrophic cells in the central nervous system, Curr Drug Targets Cardiovasc Haematol Disord, 2004, 4:65-84
15. Stence N, Waite M, Dailey ME; Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices, Glia. 2001, 33:256-66
16. Inoue K; Purinergic systems in microglia, Cell Mol Life Sci, 2008, 65:3074-80

