執筆者自身による研究論文レビュー
Tweet地主将久
『TMを介したDNA修復応答シグナルはインテグリンαvβ3依存性に抗腫瘍免疫応答逃避機構に寄与する』
更新日:2012年3月9日
原著論文:ATM-mediated DNA damage signals suppress antitumor immunity by integrin-αvβ3-dependent mechanisms. Cancer Research 72: 56-65 (2012)
連絡先:地主将久 〒060-0815 北海道札幌市北15条西7丁目 北海道大学遺伝子病制御研究所 附属感染癌研究センター 准教授 Email: Jinushi@igm.hokudai.ac.jp
概要
本研究では、がん細胞が抗癌剤耐性を獲得することで慢性恒常的なDNA損傷経路活性が誘導されATMによるNF-κB炎症シグナル活性を介して、その標的因子のひとつインテグリンαvβ3が誘導されること、さらに腫瘍細胞インテグリンαvβ3は樹状細胞による細胞貪食を促進することで、抗原特異的な抗腫瘍免疫応答を負に制御することを明らかとした。以上より、がん細胞の抗癌剤耐性機構がDNA修復応答変化を介して腫瘍免疫抑制に寄与する分子機構を明らかとした。
***
はじめに
DNA修復機構は細胞遺伝情報の統合性を保持するうえで重要な生理機構であるが、発癌においてもDNA修復シグナルを介したp53依存性の細胞死誘導活性化が、発癌抑止システムとして機能することが知られている。事実、前がん病変や初期発癌過程において認められるDNA修復シグナルのKey moleculeであるATM (=Ataxia-telangiectasia mutated)、ATR (ATM and Rad3-related) 活性化が癌進行期で減衰されることが報告されている (1)。さらに、DNA修復機構はNK細胞やT細胞に発現する免疫活性レセプターNKG2Dのリガンド発現を惹起することで、抗腫瘍免疫応答の増強に寄与していることが報告されている (2)。以上より、DNA損傷応答は内因性の遺伝情報のみならず、免疫細胞など環境因子の機能調節に重要な生体応答経路として機能する。しかし腫瘍進展や放射線暴露などで認められ恒常、慢性的なDNA修復シグナル活性は遺伝子不安定性やクロマチン修飾、p53変異など諸々の条件下においては発癌プロセスに正に作用する可能性も提唱されている (3)。以上の背景より本研究では、がん細胞の抗癌剤耐性獲得期におけるDNA修復機構の変化の有無と其の腫瘍微小環境に与える影響について検証を行なった。
結果と考察
抗癌剤による細胞死耐性機構を獲得したヒト、マウス腫瘍細胞が、ATMおよびChk2 kinaseに依存したDNA損傷経路の恒常的活性を有していることを発見した (4)。さらに、抗癌剤耐性腫瘍細胞では、ATM-Chk2 kinase依存的にインテグリンαvβ3発現の増強が誘導されることを明らかとした。ATMを介したインテグリンαvβ3誘導機構を検証したところ、MAPKやPI3K、Statなど癌遺伝子シグナルによる影響は受けない代わりに、NF-κB阻害剤により其の発現の抑制を認めることやATMノックダウン腫瘍細胞ではNF-κB阻害剤の効果が認められなかったことから、ATMはNF-κB依存性シグナル活性が抗癌剤耐性がん細胞におけるインテグリンαvβ3誘導に重要であることが明らかとなった (4)。以上の結果は、抗癌剤や放射線等をはじめとしたGenotoxic stressが、SUMOylationを介してATMの核→細胞質内への移行を促進することで、IKK-γ(NEMO)リン酸化をはじめとしたNF-κBシグナル活性による炎症応答に寄与するとういう報告 (5, 6)、およびインテグリンαvがNF-κBの標的下流因子のひとつとする報告と合致する所見であるといえる (5)。さらに、近年注目されているNF-κBを介した炎症性発癌の分子メカニズムと治療応答性を結びつける重要な発見と言える (7)。
次に、腫瘍細胞に発現するインテグリンαvβ3が腫瘍進展に果たす機能的意義を検証した。腫瘍細胞のインテグリンαvβ3が果たす役割を検証するために、抗インテグリンαvβ3阻害抗体による抗腫瘍効果を抗癌剤耐性のインテグリンαvβ3高発現B16-F10メラノーマ細胞と無処理の非発現B16-F10の野生型マウスへの皮下摂取モデルで検証したところ、抗インテグリンαvβ3阻害抗体は抗癌剤耐性細胞の腫瘍形成能を著名に抑制したが、抗癌剤無処理のB16-F10に対する効果は認めなかった。
さらに興味深いことに、この抗腫瘍効果はT細胞、B細胞などの獲得免疫能を欠損した免疫不全マウスや、抗体によりT細胞を除去した野生型マウスでは認めなかったことから、インテグリンαvβ3阻害による抗腫瘍効果にはT細胞を介した宿主免疫活性が強く寄与することが考えられた。さらに、樹状細胞は、獲得免疫に寄与する腫瘍抗原特異的T細胞に腫瘍抗原を提示するうえで重要な機能を有するが、腫瘍細胞インテグリンαvβ3は樹状細胞による腫瘍細胞の貪食能の活性化に寄与することが判明した。抗原提示細胞による細胞貪食は免疫寛容誘導に重要である(9) が、我々はインテグリンαvβ3を介した樹状細胞による腫瘍細胞の貪食促進機構が、同様に腫瘍特異的なT細胞活性抑制に寄与していることを明らかとした。
おわりに
以上より、抗癌剤耐性機構を獲得した腫瘍細胞では、ATMを介した恒常的なDNA修復シグナル活性とNF-κBによる慢性炎症シグナルを相乗的に誘導することで、その標的因子のひとつであるインテグリンαvβ3発現誘導に寄与することを同定した。さらに、腫瘍細胞上のインテグリンαvβ3 は樹状細胞による細胞貪食を促進することにより、腫瘍特異的T細胞による抗腫瘍免疫応答を有意に抑制することを見出した。
本研究では、B細胞免疫グロブリン遺伝子構成、抗癌剤をはじめとした初期のGenotoxic stressにおける急性DNA障害におけるDNA修復応答と、後期発癌や抗癌剤耐性により惹起される慢性・恒常的なDNA修復経路により惹起される微小環境への修飾応答、特に宿主免疫学機能に及ぼす生物学的影響の相異を分子学的に明らかとした。さらにこれらの成果は、抗癌剤耐性癌に対する治療戦略として、インテグリンαvβ3を標的とした新たな制癌剤開発に道を開いた点で重要であるといえる。
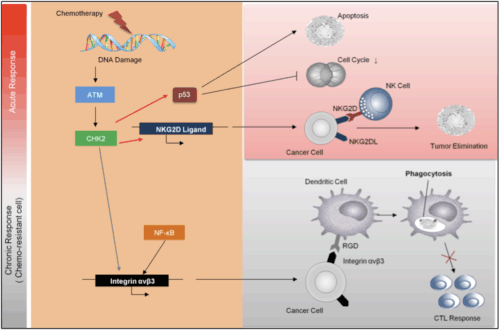
腫瘍細胞における抗癌剤応答性の変化がDNA修復機構に与える影響(上図はクリックで拡大します):抗癌剤治療早期における急性DNA障害において機能するDNA修復応答においては、p53活性による細胞死誘導やNKG2Dリガンド誘導を介した抗腫瘍免疫活性により腫瘍進展を負に制御している。それに対し、発癌や抗癌剤耐性により惹起される慢性恒常的なDNA修復経路ではATMによるNF-κBシグナル活性、およびそれに伴うインテグリンαvβ3発現誘導により、腫瘍特異的な宿主免疫応答の抑制に寄与している。
***
参考文献
1. Halazonetis TD, Gorgoulis VG, Bartek J. An oncogene-induced DNA damage model for cancer development. Science 2008; 319: 1352-5.
2. Gasser S, Orsulic S, Brown EJ, Raulet DH. The DNA damage pathway regulates innate immune system ligands of the NKG2D receptor. Nature 2005; 436: 1186-90.
3. Gilbert LA, Hemann MT. DNA damage-mediated induction of a chemoresistant niche. Cell 2010; 143: 355-66.
4. Jinushi M, Chiba S, Baghdadi M, Kinoshita I, Dosaka-Akita H, Ito K, et al. ATM-mediated DNA damage signals mediate immune evasion by integrin-αvβ3-mediated mechanisms. Cancer Res 2012; 72: 56-65.
5. Wu Z-H, Shi Y, Tibbetts RS, Miyamoto S. Molecular linkage between the kinase ATM and NF-kB signaling in response to genotoxic stimuli. Science 2006; 311: 1141-6.
6. Biton S, Ashkenazi A. NEMO and RIP1 control cell fate in response to extensive DNA damage via TNF-α feedforward signaling. Cell 2011; 145: 92-103.
7. Gilvennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell 2010; 140: 883-99.
8. Savill J, Dransfield I, Gregory C, & Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat Rev Immunol. 2002; 2: 965-975.