執筆者自身による研究論文レビュー
Tweet吉田知之、三品昌美
『Interleukin-1 Receptor Accessory Protein Organizes Neuronal Synaptogenesis as a Cell Adhesion Molecule』
更新日:2012年4月13日
原著論文:Interleukin-1 Receptor Accessory Protein Organizes Neuronal Synaptogenesis as a Cell Adhesion Molecule. The Journal of Neuroscience 32:2588-2600, 2012.
執筆者所属:東京大学大学院医学系研究科分子神経生物学教室
概要
Interleukin-1 receptor accessory protein (IL-1RAcP)はIL-1ファミリーサイトカイン受容体のシグナル伝達を担う共通サブユニットである。今回、私達はIL-1RAcPが神経細胞間のシナプス形成を誘導する強い活性を持つことを見出した。IL-1RAcPはその細胞外領域で受容体型チロシン脱リン酸化酵素PTPδと結合した。IL-1RAcPの持つシナプス前終末の誘導能はPTPδ欠損神経細胞では消失し、一方PTPδの持つシナプス後終末の誘導能はIL-1RAcP欠損神経細胞では減弱した。これらのことからシナプス後部のIL-1RAcPはトランスシナプティック細胞接着分子として機能し、シナプス前終末のPTPδを介してシナプス形成を調節することが示唆された。免疫関連分子の中枢シナプス形成における新たな機能を発見した。
***
はじめに
インターロイキン1(IL-1)ファミリーに属するサイトカインは炎症反応や免疫応答に重要な役割を担う液性分子であり、構造の良く保存されたIL-1受容体ファミリータンパク質によって受容され、細胞内にシグナルを伝える[1, 2]。 IL-1受容体はIL-1ファミリーサイトカインを受容するリガンド結合サブユニットと細胞内にシグナルを伝えるアクセサリーサブユニットから構成される。IL-1 receptor accessory protein (IL-1RAcP)はIL-1α,IL-1β,IL-33など複数のIL-1ファミリーサイトカインの受容体の共通のアクセサリーサブユニットである。最近、私達はX染色体連鎖型精神遅滞と自閉症の原因遺伝子産物Interleukin-1 receptor accessory protein-like 1 (IL1RAPL1)がPTPδを介して脳内の神経細胞間のシナプス形成を調節することを見出した[3]。IL1RAPL1は分子構造上IL-1受容体ファミリーに属するが、いずれのIL-1ファミリーサイトカインに対してもリガンド結合サブユニットとしても、またアクセサリーサブユニットとしても機能しないことが報告されていた[4]。今回、私達はIL-1受容体ファミリーに属する全タンパク質について中枢シナプス形成能の有無についてスクリーンを行った。
繊維芽細胞-神経細胞共培養によるシナプス形成誘導分子のスクリーニング
シナプスオーガナイザーと呼ばれる細胞接着分子群を発現させた繊維芽細胞と神経細胞を共培養すると、繊維芽細胞に接する神経細胞にシナプス前終末や後終末が誘導されることが知られている[5]。この共培養系を用いてすべてのIL-1受容体ファミリー蛋白質のシナプス誘導能の有無を調べた。その結果、IL-1RAcPが極めて強いシナプス前終末の誘導能を持つことが明らかになった(図1A)。IL-1RAcPの細胞外ドメインを吸着させたビーズと大脳皮質神経細胞を共培養させても同様にシナプス前終末の誘導が認められたため、IL-1RAcPのもつシナプス誘導活性には細胞外ドメインが必要十分であることが示された。
IL-1RAcPはPTPδを介してシナプス前終末を誘導する
IL-1RAcPの細胞外ドメインに結合しシナプス形成を調節する分子の検索を行った。シナプス前終末に存在することの知られている接着分子群についてIL-1RAcPの細胞外ドメインと結合するか否かを調べたところ、受容体型チロシン脱リン酸化酵素PTPδと結合することが明らかとなった。PTPδの細胞外イムノグロブリンドメイン内にはミニエクソンペプチドA (meA)、およびミニエクソンペプチドB (meB)が挿入されることによる多様なスプライスバリアントが存在することが報告されている [3, 6]。IL-1RAcPはmeBの挿入されたPTPδバリアントと効率よく結合することが判った。更に、繊維芽細胞に発現させたIL-1RAcPの持つシナプス前終末の誘導能はPTPδ欠損マウス由来の大脳皮質神経細胞に対しては有意に減弱した(図1B)。このことからIL-1RAcPはPTPδを介してシナプス前終末を誘導することが示唆された。
PTPδはIL-1RAcPbを介してシナプス後終末を誘導する
IL-1RAcPには細胞内領域の異なるスプライスバリアントIL-1RAcPbが存在することが知られている[7]。IL-1RAcPは広く様々な組織に発現するのに対してIL-1RAcPbは脳内の神経細胞特異的に発現する[7]。
IL-1RAcPbは脳内の神経細胞特異的に発現する[7]。
PTPδの細胞外ドメインを吸着させたビーズと培養大脳皮質神経細胞を共培養すると興奮性シナプス後終末が誘導された(図1C)。一方、IL-1RAcP、IL-1RAcPbの両スプライスバリアントを欠損するマウス由来の培養大脳皮質神経細胞に対するPTPδビーズのシナプス後終末誘導能は有意に減弱した。更にPTPδビーズのシナプス後終末誘導能はIL-1RAcPではなくIL-1RAcPbを発現させることによって回復した(図1D)。これらの結果からPTPδはIL-1RAcPbを介してシナプス後終末を誘導することが示唆された。
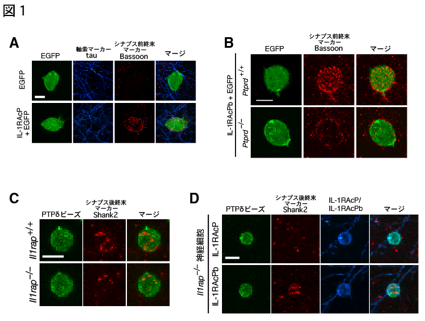
図1:
(A) IL-1RAcPを発現させた繊維芽細胞と大脳皮質神経細胞の共培養。IL-1RAcPを発現させた繊維芽細胞の周囲にシナプス前終末マーカーのBassoonが集積した。(B) 繊維芽細胞に発現させたIL-1RAcPによるシナプス前終末の誘導はPTPδ欠損培養神経細胞(Ptprd-/-)に対しては殆ど見られなかった。(C) PTPδの細胞外ドメインを吸着させたビーズと大脳皮質神経細胞との共培養。PTPδビーズによるシナプス後終末の誘導能はIL-1RAcP欠損神経細胞(Il1rap-/-)では顕著に減少した。(D) IL-1RAcP欠損マウス由来培養神経細胞に対するPTPδビーズのシナプス後終末の誘導はIL-1RAcPbバリアントでレスキューされた。(画像はクリックで拡大します)
IL-1RAcPアイソフォームは海馬及び大脳皮質のシナプス形成に重要である
IL-1RAcP、IL-1RAcPbの両スプライスバリアントを欠損するマウスにおいて、海馬CA1領域及び大脳皮質2/3層の錐体細胞の樹状突起のスパインの数が顕著に減少していることが明らかになった。また、PTPδの欠損マウスにおいてもこれらの脳領域でスパインの減少が報告されている[3]。これらのことからin vivoにおいてIL-1RAcPアイソフォームとPTPδの結合が興奮性シナプス形成に重要な役割を担うことが示唆された。即ちIL-1RAcPはIL-1受容体として免疫応答や炎症反応の調節を担う様式とは全く異なる様式で中枢シナプス形成を調節することが明らかになった(図2)。
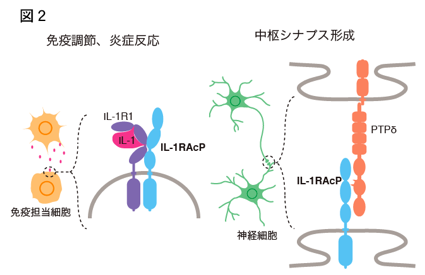
図2. IL-1RAcPの細胞接着分子としての新規機能:
(A) 免疫応答、炎症反応の調節におけるIL-1RAcPのシグナル伝達様式。(B) 中枢シナプス形成におけるトランスシナプティック細胞接着分子としてIL-1RAcPのシグナル伝達様式。
今後の研究課題
神経細胞間のシナプスの形成と再編は脳の発達に伴い神経回路が作られる際、記憶学習の際に起こる極めて重要なステップであり、シナプスの形成と再編機構の破綻は自閉症、精神遅滞などの発病と深く関わることが示唆されている。シナプス形成の調節機構の解明はこれらの神経発達障害の病態の理解と治療法の開発の為に不可欠である。今後、IL-1RAcPアイソフォームとPTPδによるシナプス形成複合体から双方向性にシナプス前終末・後終末が分化誘導される分子メカニズムを明らかにすることが中枢シナプス形成の基本原理と神経発達障害の発病機構の理解につながると期待される。また、IL-1などの従来のIL-1受容体リガンドが中枢シナプス形成の調節に関与するのか、更にはPTPδがIL-1の免疫シグナル伝達の調節に関与するか、興味が持たれるところである。
***
参考文献
1.Dinarello CA (2009) Immunological and inflammatory functions of the interleukin-1 family. Annu Rev Immunol 27: 519−550.
2. Sims JE, Smith DE (2010) The IL-1 family: regulators of immunity. Nat Rev Immunol 10: 89−102.
3. Yoshida T, Yasumura M, Uemura T, Lee S, Ra M, Taguchi R, Iwakura Y, Mishina M (2011) IL-1 receptor accessory protein-like 1 associated with mental retardation and autism mediates synapse formation by trans-synaptic interaction with protein tyrosine phosphatase δ. J Neurosci 31:13485−13499.
4. Born TL, Smith DE, Garka KE, Renshaw BR, Bertles JS, Sims JE (2000) Identification and characterization of two members of a novel class of the interleukin-1 receptor (IL-1R) family. Delineation of a new class of IL-1R-related proteins based on signaling. J Biol Chem 275: 29946−29954.
5. Scheiffele P, Fan J, Choih J, Fetter R, Serafini T (2000) Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell 101: 657−669.
6. Pulido R, Serra-Page`s C, Tang M, Streuli M (1995) The LAR/PTPδ/PTPσ subfamily of transmembrane protein-tyrosine-phosphatases: multiple human LAR, PTPδ, and PTPσ isoforms are expressed in a tissue-specific manner and associate with the LAR-interacting protein LIP.1. Proc Natl Acad Sci USA 92: 11686−11690.
7. Smith DE, Lipsky BP, Russell C, Ketchem RR, Kirchner J, Hensley K, Huang Y, Friedman WJ, Boissonneault V, Plante MM, Rivest S, Sims JE (2009) A central nervous system-restricted isoform of the interleukin-1 receptor accessory protein modulates neuronal responses to interleukin-1. Immunity 30: 817−831.