執筆者自身による研究論文レビュー
Tweet星雅人1, 2、清島満2、斉藤邦明3
『L-Tryptophan-kynurenine pathway metabolites regulate type I IFNs of acute viral myocarditis in mice』
更新日:2012年6月18日
原著論文:L-Tryptophan-kynurenine pathway metabolites regulate type I IFNs of acute viral myocarditis in mice. The Journal of Immunology 188: 3980-3987, 2012.
執筆者所属:1鈴鹿医療科学大学 保健衛生学部 医療栄養学科、2岐阜大学大学院医学系研究科 病態情報解析医学、3京都大学大学院医学研究科 基礎検査展開学
概要
Indoleamine 2,3-dioxygenase (IDO)は種々の感染症により誘発されたサイトカイン等により酵素誘導され、トリプトファン (Trp)をキヌレニン経路へと代謝する。しかし、ウイルス感染症においてTrp代謝産物が免疫機構に及ぼす影響の全容は未だ明らかではない。本稿では、EMCV感染により誘発されるIDOはトリプトファンをキヌレニン経路に代謝し、増加した代謝産物が骨髄由来マクロファージを抑制することでI型インターフェロンの産生制御に重要な役割を有することを明らかにした。
***
はじめに
必須アミノ酸であるTrpは、主に肝臓で恒常的に発現しているトリプトファン酸素添加酵素あるいはIDOにより約95%がキヌレニン経路へと代謝される。IDOは種々の炎症性サイトカイン等により酵素誘導され、抗原提示細胞(マクロファージや樹状細胞等)をはじめ種々の上皮細胞や腫瘍細胞において強発現することで知られている。近年IDO酵素誘導による結果として、局所のトリプトファン枯渇によるストレスで活性化されたgeneral control non-depressive 2 (GCN2) kinaseによって細胞周期をG1期に停止させることや、CD95L (FASL)誘導性アポトーシスを惹起すること、あるいはキヌレニン(Kyn)に代表されるTrp代謝産物の細胞毒性によりT細胞やNK細胞などの増殖抑制及び細胞死が誘導されると報告されている1)-3)。著者らは、レトロウイルスに感染したIDO遺伝子欠損マウス(IDO-KO)及び特異的阻害剤を投与(1-metyl-DL-tryptophan: 1-MT)したマウスのI型インターフェロン(Type I IFN)が野生型マウス(WT)と比較して有意に増加し、ウイルス量を抑制することを報告した4)。しかし、ウイルス感染時にIDOが欠損及び阻害されることにより、Trp代謝がType I IFNの制御に対してどのように関与しているのかは明らかではなかった。本稿では、マウス脳心筋炎ウイルス(Encephalomyocarditis virus : EMCV)感染モデルマウスを使用し、Trp代謝におけるType I IFN産生の制御機構について最新の知見を紹介する5)。
結果と考察
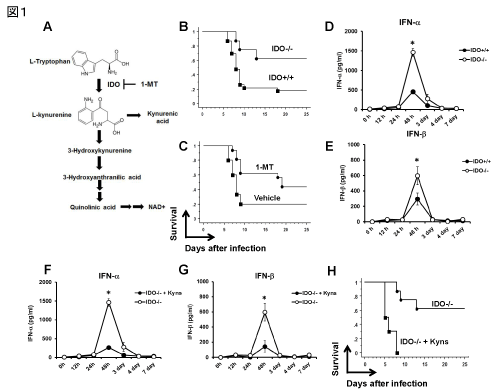
EMCV(500pfu)に感染したC57BL6/Jマウス(6週齢、オス)は、感染後48 時間で血清Kyn、3-hydroxykinurenine (3-HK)が有意に増加し、脾臓及び肺臓でIDOの顕著な酵素活性の上昇が見られた。さらに、感染後4日の心筋に浸潤した細胞でのIDOは有意に増加していた(図示せず)。すなわち、図1Aに示すように、各種臓器(細胞)でのIDO活性の誘導に伴い、TrpがKyn経路により代謝され各種血中Trp代謝産物の濃度を増加させたと考えられる。最近の研究では、poly (I:C)刺激により誘導されたアストロサイトでのIDO誘導は、抗ウイルス作用を有するといった報告や6)、他方ではHIV感染症でのIDO誘導阻害(1-MT)はT細胞の誘導を促すことで抗ウイルス作用に働くといった報告7)がある。本研究結果は、EMCV感染によりIDO-KO及び1-MT投与マウスでWTと比較し有意に生存率の増加とウイルス量を抑制することが示された(図1B, C)。EMCVは、生体内に侵入すると樹状細胞あるいはマクロファージに発現しているmelanoma differentiation-associated gene 5 (MDA5)receptorにより認識され、Type I IFN及び炎症性サイトカインが産生され、ウイルスを抑制し生体防御に働くことが知られている。実際、EMCV感染後経時的にType I IFNの血清中濃度を比較したところ、WTと比較しIDO-KO及び1-MT投与マウスで有意な増加を認めた(図1D, E)。マウスレトロウイルス感染症においても著者らは同様の知見を明らかにし、本研究ではTrp代謝産物のカクテル(Kyns : Kyn, 3-HK, 3-hydroxyanthranilic acid)を作製し、IDO-KOマウスに腹腔内投与(20 mg/kg/day)した。その結果Type I IFN濃度はWTとほぼ同様となり、実際生存率においてもKyns投与群では未投与群に比較して有意に低下していた(図1F-H)。したがって、Type I IFNの産生制御には、EMCV感染によるIDO誘導を介して増加するTrp代謝産物が深く関与していることが明らかであり、複数種のウイルス感染症においても同様の機構が関与している可能性が示唆される。
図1.EMCV感染したIDO遺伝子欠損マウスにおけるType I IFN産生とTrp代謝産物による影響:A.Trp-Kyn代謝経路を示す。1-MT :IDO特異的阻害剤。B, C. EMCV感染WT (IDO+/+)とIDO-KO (IDO-/-)の生存率及びWTとIDO阻害剤投与マウス (1-MT) における生存率の比較。IDO-KO及び1-MT投与マウスにおいて有意に生存率の増加がみられた (P < 0.05)。D, E. EMCV感染IDO-KOとWTにおける血中Type I IFN量の経時的変化。IDO-KOにおいて感染後48時間で有意な増加を認めた (* P < 0.05)。F, G. IDO-KO及びIDO-KOにKynカクテル
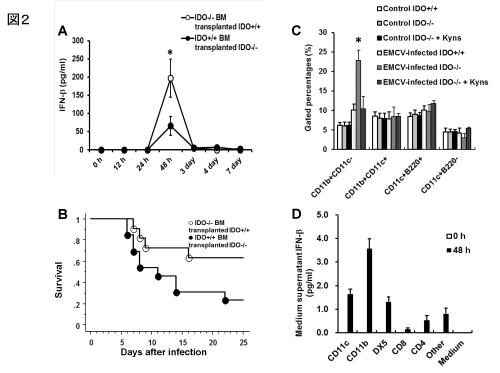
Trp代謝産物は、in vitroの実験系においてT細胞、NK細胞あるいはマクロファージに対し細胞毒性があり、細胞増殖抑制や細胞死を誘導することが知られている1)。さらにKynの増加はNF-kB活性を阻害することが報告されている8)。著者らは、本研究でTrp代謝産物増加によるType I IFN産生制御に重要な役割を持つ細胞フェノタイプを明らかにするため、骨髄移植したマウスを用いた。図2Aに示す通り、IDO-KOマウスの骨髄をWTに移植した群(IDO-/- BM transplanted IDO+/+)にEMCVを感染させ経時的に血中Type I IFN量を測定したところ、WTマウスの骨髄をIDO-KOに移植した群(IDO+/+ BM transplanted IDO-/-)と比較し有意に増加していた。さらにIDO-KO骨髄移植WT群では有意に生存率の増加を認めた(図2B)。すなわち、IDO-KOマウスでみられたType I IFN産生の増加には、骨髄由来細胞が重要な因子として考えられる。さらに、EMCV感染後48時間で脾臓より得られた細胞フェノタイプ(CD11b+CD11c-, CD11b+CD11c+, CD11c+B220+, CD11c+B220-)を解析したところ、IDO-KOマウスではCD11b+CD11c-細胞がWTと比較して有意に割合及び細胞数が増加しており、本現象はKynsの投与により解除された(図2C)。またType I IFN産生細胞として、EMCV感染後48時間で各種細胞(CD11c+, CD11b+, DX5+, CD8+, CD4+, other)を単離し、培養上清中のType I IFN量を測定したところ、CD11b+細胞で明らかな産生増加がみられた(図2D)。同様の知見として、著者らはα-ガラクトシルセラミド誘発肝炎モデルにおいて肝臓内CD11b+細胞数が増加していることを報告している9)。したがって、Trp代謝によるType I IFNの産生制御機構は、IDO誘導により多量のTrp代謝産物が生成され、これら代謝産物が骨髄由来CD11b+細胞を抑制することによりType I IFNの産生量を制御し、ウイルス量を抑制していると考えられる。
図2.骨髄移植を用いたEMCV感染マウスにおけるType I IFN産生細胞の同定とTrp代謝産物の影響:A. IDO-KOの骨髄をWTに移植した群 (IDO-/- BM transplanted IDO+/+)とWTの骨髄をIDO-KOに移植した群(IDO+/+ BM transplanted IDO-/-)におけるEMCV感染後の血中Type I IFN量の経時的変化(上図)。IDO-KOの骨髄由来細胞がType I IFNの増加に重要である (* P < 0.05)。B. 同様に骨髄移植をした群におけるEMCV感染による生存率の比較(下図:P < 0.05)。C. WT, IDO-KO及びKyns投与IDO-KOを用いてEMCV未感染及び感染群マウスの脾細胞より得られたフェノタイプの割合をflow cytometerを用いて解析した。EMCV感染IDO-KOではCD11b+CD11c-細胞が有意に増加(* P < 0.05)しており、Kynsの投与で本細胞の増加は解除される。D. EMCV感染後48時間でWTの脾臓より得られた各種細胞(1×106/well)を72時間培養し、培養上清中のType I IFN量をELISA法で測定した。
おわりに
本稿では、IDOを中心としたTrp代謝がType I IFNの産生を制御する免疫機構について最新の知見を紹介した。最近、アミノ酸の枯渇によりmammalian target of rapamycin (mTOR)を制御し、Type I IFNの産生を阻害することや10)、TGF-βで刺激された形質細胞様樹状細胞においてIDOが転写因子としての機能を有することが知られている11)。したがって、IDOの誘導及びそれに伴うTrp代謝(代謝産物)が細胞レベルでどのように関与しているのかは未知の部分が多く、今後の課題としてIDO及びTrp代謝産物が細胞数を制御するだけではなく、Type I IFN産生シグナルに及ぼす影響や細胞成熟過程に及ぼす影響など多方面から解析する必要があると考えられる。
***
参考文献
1. Terness, P., T. M. Bauer, L. Rose, C. Dufter, A. Watzlik, H. Simon, and G. Opelz. 2002. Inhibition of allogeneic T cell proliferation by indoleamine 2,3-dioxygenase-expressing dendritic cells: mediation of suppression by tryptophan metabolites. J. Exp. Med. 196:447-457.
2. Frumento, G., R. Rotondo, M. Tonetti, G. Damonte, U. Benatti, and G. B. Ferrara. 2002. Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2,3-dioxygenase. J. Exp. Med. 196:459-468.
3. Fallarino, F., U. Grohmann, C. Vacca, R. Bianchi, C. Orabona, A. Spreca, M. C. Fioretti, and P. Puccetti. 2002. T cell apoptosis by tryptophan catabolism. Cell. Death. Differ. 9:1069-1077.
4. Hoshi, M., K. Saito, A. Hara, A. Taguchi, H. Ohtaki, R. Tanaka, H. Fujigaki, Y. Osawa, M. Takemura, H. Matsunami, H. Ito, and M. Seishima. 2010. The Absence of IDO Upregulates Type I IFN Production, Resulting in Suppression of Viral Replication in the Retrovirus-Infected Mouse. J. Immunol. 185:3305-3312.
5. Hoshi M, Matsumoto K, Ito H, Ohtaki H, Arioka Y, Osawa Y, Yamamoto Y, Matsunami H, Hara A, Seishima M, Saito K. 2012. L-Tryptophan-Kynurenine Pathway Metabolites Regulate Type I IFNs of Acute Viral Myocarditis in Mice. J Immunol. 188(8):3980-7.
6. Suh, H. S., M. L. Zhao, M. Rivieccio, S. Choi, E. Connolly, Y. Zhao, O. Takikawa, C. F. Brosnan, and S. C. Lee. 2007. Astrocyte indoleamine 2,3-dioxygenase is induced by the TLR3 ligand poly (I:C): mechanism of induction and role in antiviral response. J. Virol. 81:9838-9850.
7. Boasso, A., J. P. Herbeuval, A. W. Hardy, S. A. Anderson, M. J. Dolan, D. Fuchs, and G. M. Shearer. 2007. HIV inhibits CD4+ T-cell proliferation by inducing indoleamine 2,3-dioxygenase in plasmacytoid dendritic cells. Blood 109:3351-3359.
8. Hayashi, T., J. H. Mo, X. Gong, C. Rossetto, A. Jang, L. Beck, G. I. Elliott, I. Kufareva, R. Abagyan, D. H. Broide, J. Lee, and E. Raz. 2007. 3-Hydroxyanthranilic acid inhibits PDK1 activation and suppresses experimental asthma by inducing T cell apoptosis. Proc. Natl. Acad. Sci. USA 104:18619-18624.
9. Ito, H., M. Hoshi, H. Ohtaki, A. Taguchi, K. Ando, T. Ishikawa, Y. Osawa, A. Hara, H. Moriwaki, K. Saito, and M. Seishima. 2010. Ability of IDO To Attenuate Liver Injury in {alpha}-Galactosylceramide-Induced Hepatitis Model. J. Immunol. 185:4554-4560.
10. Gao, X., Y. Zhang, P. Arrazola, O. Hino, T. Kobayashi, R. S. Yeung, B. Ru, and D. Pan. 2002. Tsc tumour suppressor proteins antagonize amino-acid-TOR signalling. Nat. Cell. Biol. 4:699-704.
11. Pallotta, M. T., C. Orabona, C. Volpi, C. Vacca, M. L. Belladonna, R. Bianchi, G. Servillo, C. Brunacci, M. Calvitti, S. Bicciato, E. M. Mazza, L. Boon, F. Grassi, M. C. Fioretti, F. Fallarino, P. Puccetti, and U. Grohmann. 2011. Indoleamine 2,3-dioxygenase is a signaling protein in long-term tolerance by dendritic cells. Nat. Immunol. 12:870-878.