執筆者自身による研究論文レビュー
Tweet執筆者:内堀亮介、小澤敬也
タイトル:間葉系幹細胞の腫瘍集積性に関わる分子機構の解明
更新日:2013年2月27日
原著論文:NF-κB Activity Regulates Mesenchymal Stem Cell Accumulation at Tumor Sites. Cancer Research 73: 364-372, 2013.
執筆者所属:自治医科大学分子病態治療研究センター遺伝子治療研究部、自治医科大学免疫遺伝子細胞治療学(タカラバイオ)講座
概要
MSCの腫瘍集積性というユニークな性質を利用した治療戦略の技術開発が、抗がん作用を有する治療薬のがん病巣へのターゲティング技術という観点において重要な研究テーマとなっている。本研究では、MSCの腫瘍集積性に関わる分子機構を解析し、それを規定する1つの機構として、腫瘍局所でのTNF-αによるNF-κBシグナル経路を介した接着分子の発現誘導と、それに伴う血管内皮細胞への接着性の亢進が重要であることを明らかにした。
***
間葉系幹細胞
間葉系幹細胞(mesenchymal stem cell: MSC)は骨髄や脂肪組織などから容易に採取・分離できる未分化細胞であり、造血支持組織として骨髄間質を構成する細胞成分に分化するだけでなく、脂肪細胞・骨細胞・軟骨細胞・筋細胞・腱などの中胚葉系のさまざまな組織に分化する能力をもった細胞として、再生医療の分野への応用が期待されている。また、造血幹細胞移植の領域では、MSCの造血支持能により、移植後の生着促進と造血系再構築促進の効果が期待されている1)。さらに、MSCの免疫抑制作用を利用した重症GVHDの治療についても、臨床研究が行われている。MSCが炎症部位や組織傷害部位に集積する性質があることも、GVHDの治療には都合が良いと考えられている。その他、MSCの免疫抑制作用は移植片の拒絶を防ぐ意味でも期待されており、MSCを併用して移植する、ハプロアイデンティカル移植などの臨床研究も実施されている。
MSCの癌治療への応用
MSCは一種の炎症組織であるがん病巣にも同様に集積することが知られており、MSCをがんに対する遺伝子治療のプラットフォームとして利用するという発想が生まれてきた。MSCを用いる最大の利点は、治療用遺伝子を腫瘍局所で作用させることができるため、効率的かつ効果的であという点にある。さらに全身性の副作用を極力減らすことも期待できる。これまでに、インターフェロン-βを発現するMSCを担がんマウスに静脈内投与すると、そのマウスの生存期間が延長するとの観察を始め、さまざまな報告がなされている2)。我々の研究グループも、MSCにベクター産生能を付与することによって、ベクター産生型MSCの腫瘍へのターゲティングに加え、腫瘍局所における治療遺伝子の増幅を介して当該遺伝子の発現レベルを高めるシステムを考案し、HSV-tk/GCVによるがんの自殺遺伝子療法で腫瘍の増殖遅延効果が認められることを報告している3)。
MSCと腫瘍の関わり
MSCが腫瘍に集積する意義として、MSCが腫瘍の増殖を支持する役割を担っていることが挙げられる。腫瘍の増殖には内皮細胞や周皮細胞(pericyte)がさまざまな成長因子を腫瘍局所において産生して組織の構築に関与しているが4)、MSCも同様に機能していると考えられている。腫瘍に集積したMSCは、がん間質における線維芽細胞(cancer-associated fibroblast)へとその形質を変化させて腫瘍の微小環境を構築し、腫瘍の増殖を構造的に支持すると考えられている2)。また、in vitroにおいて、ヒト乳がん細胞株の培養上清でMSCを刺激すると、MSCはCCL5(RANTES)を過剰分泌し、乳がん細胞の浸潤・転移能が亢進するとの報告もある5)。
しかし一方では、興味深いことに、MSCは腫瘍増殖を直接的に抑制する性質を有している。MSCは腫瘍細胞とE-カドヘリンを介して接着し、腫瘍細胞側のAktのリン酸化を抑制することでアポトーシスを誘導する6)。さらに、腫瘍細胞に対して細胞周期の進行をブロックするp21や、アポトーシス関連酵素であるカスパーゼ3の発現を腫瘍細胞に発現させる性質があることも明らかになっている7)。その他、MSCがDKK-1(Dickkop-1)を分泌することで、腫瘍細胞のWnt/β-カテニンシグナルを抑制して悪性形質を減弱化することも報告されている8)。
いずれにせよ、がん治療への応用という視点からは、MSC単独ではがん細胞の増殖に有利に作用したり、がんに対する免疫学的監視機構を抑制してしまい、逆効果になってしまうことが懸念事項として挙げられる。したがって、可能な限り強力な抗腫瘍性サイトカインを腫瘍局所で産生させることがこの治療法の成否を握ると考えられる。そのためには、MSCの腫瘍集積メカニズムの十分な理解が必要となる。
MSCの腫瘍集積メカニズム
腫瘍が増殖する過程で腫瘍組織にはさまざまな炎症性細胞が浸潤し、さまざまな増殖因子やサイトカインが産生されて腫瘍の増殖・進展が促進され、MSCはこれらの因子に対して遊走活性を有するため、生体内に投与されたMSCはその濃度勾配に従って遊走・集積すると考えられてきた9)。しかし、こうした報告にも関わらずMSCの集積性を規定する分子機構には未だ不明な点が多いのも事実であり、我々はその機序を明らかにすべく、研究を行った10)。
ヒト大腸がん細胞株SW480をヌードマウスの皮下に接種し、その一週間後にヒト骨髄由来MSCを担がんマウスの左心室腔内に投与すると、腫瘍を接種した部位でMSCからの強い発光が観察される(図1A)。一方、ヒト胎児肺由来の線維芽細胞WI-38を同様の方法で投与しても、腫瘍への集積は認められなかった。MSCとWI-38の増殖因子やケモカインに対する遊走能を比較したところ、MSCよりも線維芽細胞の方が強い遊走活性を示したため、MSCの腫瘍集積性は増殖因子やケモカインに対する遊走活性のみで規定されているわけではないことが示唆された。
SW480をヌードマウスの皮下に移植すると血管に富む腫瘍間質の形成が認められ、MSCの集積はこの間質領域に(特に腫瘍との境界領域)に認められる。そこで我々は、MSCが腫瘍に集積するステップの1つとして、血管内皮細胞への接着が重要なのではないかと考えた。この相互作用を解析する上で、白血球が炎症組織に浸潤する際のモデルとして提唱されているマルチステップモデルを参考にした。
担がんモデルマウスの腫瘍組織中の炎症性サイトカイン量をELISAで確認すると、特にTNF-αの産生が亢進していた。MSCをTNF-αで刺激すると、WI-38と比較してVCAM-1(Vascular Cell Adhesion Molecule-1)やVLA-4(Very Late Antigen-4)などの接着分子の発現(図1B)ならびに内皮細胞への接着性が亢進し、それらの抗体存在下では接着性が低下した(図1C)。
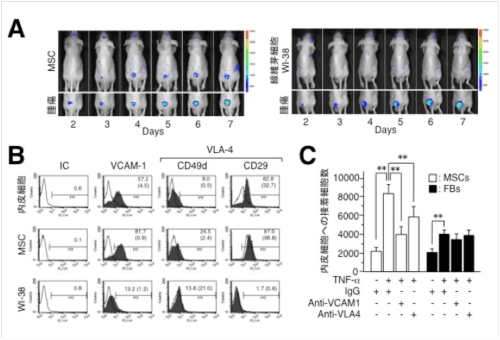
図1. MSCとWI-38の腫瘍集積性と内皮細胞への接着性の比較(参考文献10より):A) SW480を皮下接種した担がんマウスに、ルシフェラーゼ発現MSC(左)またはWI-38(右)を左心室腔内から投与して、腫瘍集積性を生体イメージング装置で経時的に解析した。上段はルシフェラーゼの発光測定により投与細胞の動態を、下段は腫瘍部位を示した。(B) 内皮細胞、MSC、WI-38の培養系にTNF-αを添加し、接着分子の発現をフローサイトメーターで測定した。△: TNF-α無添加群、▲: TNF-α添加群。(C) 内皮細胞の培養系に蛍光色素で標識したMSCまたはWI-38を添加し、30分後に非接着細胞を洗い流して、残存細胞の蛍光強度から接着細胞数を算出した。
このTNF-α刺激による接着分子の発現誘導にはNF-κBシグナル経路が関与しているが、NF-κBの阻害剤であるパルテノライドを添加した培養系ではp65の核移行が阻害され(図2A)、TNF-α刺激後のVCAM-1の発現が抑制された(図2B)。パルテノライドで処理したMSCは内皮細胞への接着性が有意に低下し(図2C)、このMSCを担がんマウスに投与すると腫瘍集積性の低下が認められた(図2D)。
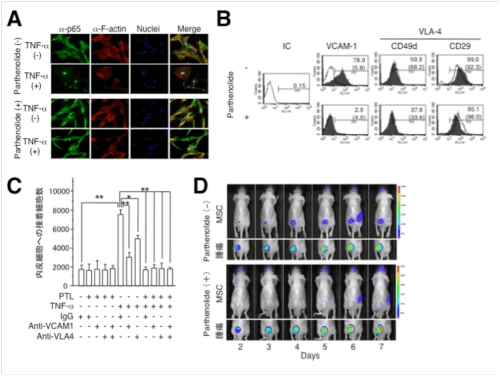
図2. NF-κBの阻害によるMSCのVCAM-1発現と腫瘍集積性の抑制(参考文献10より):(A) パルテノライドで処理したMSCの培養系にTNF-αを添加して、P65の核移行が阻害されることを確認した。(B) パルテノライドで処理したMSCの培養系にTNF-αを添加して、接着分子の発現誘導をフローサイトメーターで測定した。△: TNF-α無添加群、▲: TNF-α添加群。 (C) 内皮細胞の培養系にパルテノライドで処理した蛍光標識MSCまたはWI-38を添加し、30分後に非接着細胞を洗い流して、残存細胞の蛍光強度から接着細胞数を算出した。(D) SW480を皮下接種した担がんマウスに、パルテノライドで処理したルシフェラーゼ発現MSCを左心室腔内から投与して、腫瘍集積性を生体イメージング装置で経時的に解析した。
これらの結果から、TNF-α刺激によるNF-κBシグナル経路を介した接着分子の発現誘導が、MSCの腫瘍集積性を規定する分子機構の1つであることが示された。血管内皮細胞に接着したMSCは、その後血管外へと遊出し、腫瘍との境界領域に向かって腫瘍間質内を遊走すると考えられる。この過程において、脳腫瘍への遊走性がMSCのMMP-1発現レベルに依存しているという、とても興味深い報告もある。内皮細胞に接着した後のMSCの動態について詳細な解析は行っていないが、この一連の過程が実際にどのように進行するかについては今後の研究課題として明らかにしていきたい。
がん組織におけるTNF-αの発現意義として、がん細胞にアポトーシス抵抗性、増殖・転移の促進などがんの悪性化に関与していることが挙げられ、さまざまな腫瘍でその発現が認められている11), 12)。したがって、MSCを用いた腫瘍標的化療法は幅広い腫瘍に適応可能であり、原発巣のみならず転移巣をも標的化しうる治療ストラテジーの構築が期待される。
***
参考文献
1) Pitteger MF, Mackay AM, Beck SC, et al: Multiliniage potential of adult human mesenchymal stem cells. Science 284: 143-147, 1999.
2) Studeny M, Marini FC, Dembinski JL, et al: Mesenchymal stem cells: potential precursors for tumor stroma and targeted-delivery vehicles for anti cancer agents. J Natl Cancer Inst 96: 1595-1603, 2004.
3) Uchibori R, Okada T, Ito T, et al: Retroviral vector-producing mesenchymal stem cells for targeted suicide cancer gene therapy. J Gene Med 11: 373-381. 2009.
4) Birnbaum T, Roider J, Schankin CJ, et al: Malignant gliomas actively recruit bone marrow stromal cells by secreting angiogenic cytokines. Neurooncology 83: 241-247, 2007.
5) Karnoub AE, Dash AB, Vo AP, et al: Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature 449: 557-563, 2007.
6) Khakoo AY, Pati S, Anderson SA, et al: Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi’s sarcoma. Exp Med 203: 1235-1247, 2006.
7) Lu YR, Yuan Y, Wang XJ, et al: The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer Biol Ther 7: 245-251, 2008.
8) Etheridge SL, Spencer GJ, Heath DJ, et al: Expression profiling and functional analysis of wnt signaling mechanisms in mesenchymal stem cells. Stem Cells 22: 849-860, 2004.
9) Honczarenko M, Lea Y, Swierkowski M, et al: Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors. Stem Cells 24: 1030-1041, 2006.
10) Uchibori R, Tsukahara T, Mizuguchi H, et al: NF-κB Activity Regulates Mesenchymal Stem Cell Accumulation at Tumor Sites. Cancer Res 73: 364-372, 2013.
11) Balkwill F: Tumour necrosis factor and cancer. Nat Rev Cancer 9: 361-371, 2009.
12) Wu Y, Zhou BP: TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion. Br J Cancer 102: 639-644, 2010.

