執筆者自身による研究論文レビュー
Tweet執筆者:清水佳奈子、藤井眞一郎
タイトル:自然免疫と獲得免疫の両方を活性化する新規がん細胞療法 ー人工アジュバントベクター細胞の開発ー
更新日:2013年3月11日
原著論文:Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Research 73: 62-73, 2013.
執筆者所属:理化学研究所 免疫・アレルギー科学総合研究センター 免疫細胞移植戦略研究ユニット
概要
生体防御を担う免疫系には、抗原非特異的に初期防御を担う「自然免疫」と、抗体やさまざまな細胞性免疫応答によって特定の異物を強力に認識し排除する「獲得免疫」があり、癌の免疫監視機構には両者が必要である。本研究では、自然免疫、獲得免疫を誘導する新しいコンセプトの癌ワクチンとして人工アジュバントベクター細胞を開発し、前臨床試験としてマウス、イヌ、ヒト免疫細胞移植マウスモデルでその有効性を検討した。
***
NKT細胞の生物学的特徴
NKT細胞は自然免疫の代表的な細胞で、T細胞とNK細胞の両方の受容体を発現している免疫調節細胞であり、リンパ節には少ないものの、主に肝臓、脾臓、肺、骨髄などの臓器に存在する1)。T細胞受容体(TCR)のα鎖に可変性のないインバリアント鎖(マウスではVα14Jα18、ヒトではVα24Jα18)を発現するiNKT細胞はCD1d分子上に提示された糖脂質抗原を認識する。iNKT細胞は抗原刺激やIL-12などの炎症性サイトカインにより短時間で大量のサイトカイン(特にIFN-γ)を産生し、直接抗腫瘍活性を発揮する。また、生体内においてiNKT細胞の活性化後に起こる二次的樹状細胞の成熟化は他の免疫担当細胞の活性化を促進し、免疫カスケードを動かす2,3)。このDCの成熟化のメカニズムとしては、iNKT細胞から産生されるサイトカイン(TNF-αとIFN-γ)とNKT細胞に発現するCD40Lのシグナルが鍵を握る4)。成熟化の過程で蛋白抗原に曝露されると生体内DCはその抗原を取り込み、iNKT細胞の活性化により成熟化をおこし、抗原特異的なT細胞誘導を可能にする。このような成熟化樹状細胞の特徴としては (i)DCの表面マーカーの成熟化:MHCクラスIとIIの強発現、CD40、CD70、CD80、CD86などの共刺激分子や接着分子の強発現、(ii)アロリンパ球混合反応(MLR)刺激能の増強、(iii)炎症性サイトカイン(IL12)やT細胞を引き寄せるケモカイン(CCL17)の産生5)、(iv)抗原特異的なT細胞免疫応答誘導の4項目があげられる1)。
人工アジュバントベクター 細胞(artificial Adjuvant vector cells; 以下aAVCs)療法の免疫機構
前述したようにiNKT細胞の特徴は、自らの活性化を引き金に他の自然免疫細胞を活性化するのみならず、生体内の樹状細胞を効率良く成熟化させることにある。我々はこれまで、この免疫機構を最大限利用した癌ワクチンの開発に取り組み、CD1d発現細胞に腫瘍抗原とNKTリガンド(α-GarCer)を同時に発現させることにより、NK細胞、NKT細胞などの自然リンパ球の活性化と抗原特異的なT細胞を最も効率良く誘導し、抗腫瘍効果を示すことを明らかにした。このような細胞を人工アジュバントベクター細胞と提唱している6,7,8)。この細胞の免疫応答は、リガンドにより誘導された活性化NKT細胞が、反対に標的細胞(aAVCs)を殺傷し細胞死を起こさせることがトリガーとなる。この結果として得られる獲得免疫は死細胞を積極的にとりこむDCの特性を利用したターゲッティング療法といえる 。
<マウスaAVCモデルでの検証>
マウスモデルのベクター細胞としては、遺伝子導入効率が良く、且つ殺傷されやすいアロ細胞、NIH3T3細胞株を選択した。NIH3T3細胞にNKTリガンドが提示されやすいようCD1dを強発現させ、iNKTリガンドであるα-GarCerをパルスし、更にモデル抗原としてOVA抗原の全長のmRNAを導入させたCD1dhi-NIH3T3/Gal-ovaを作製した。CD1dhi-NIH3T3/Gal-ova細胞はMHCミスマッチのためレシピエント(B6)のT cellに直接提示することができない。しかし、OVA特異的CD8T細胞(OT-I)を移入したB6マウスにこの細胞を免疫するとOT-I細胞の増殖を認めた。この免疫応答において、宿主のDCを除去すると免疫応答が消失することにより、これは宿主DCがOVA抗原を交差提示することを示している7)。OT-1を移入しない、B6 ナイーブマウスをCD1dhi-NIH3T3/Gal-ovaで免疫した場合も、脾臓、肝臓、肺にOVA特異的CD8T細胞が高率に誘導された。一方OVAmRNAを同じ条件で遺伝子導入した骨髄由来DCをB6マウスに免疫するとOVA特異的CD8T細胞は誘導できるものの、aAVCには及ばなかった。またNKTリガンドをDCにパルスしても、T細胞誘導における相乗効果は認めなかった8)。

<ヒト型aAVC療法開発の前臨床試験>
(1)ヒト細胞における有効性の評価
次にヒト型aAVCの開発のため、ベクター細胞を細胞増殖率、NKT活性化能、遺伝子導入効率の3点から、16種類のヒト細胞株をスクリーニングした。その結果、HEK293細胞株が最適であることが判明し、ヒトaAVC細胞が、マウスモデルの様に免疫応答を惹起するかどうか検討した。
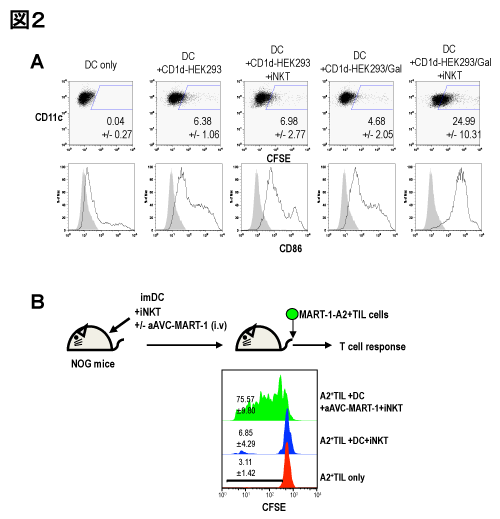
樹状細胞の交差提示が本治療のメカニズムとして重要であることは前述したとおりである。そこでまずヒト樹状細胞が、aAVCを貪食するかどうかを検討した。CFSEでラベルしたaAVCと未熟DCを共培養し、DCの取り込みを評価すると、NKT細胞存在下では非存在下に比べ4倍のaAVCが取り込まれることが判明した。またこの細胞片を取り込んだ樹状細胞はNKT細胞依存性に成熟化を示した。一方NKT細胞の活性化を評価すると、NKTリガンドをパルスしたaAVCの群だけがNKT細胞の活性化(IFN-γ産生)を認めなかった。
次に実際にヒトDCが抗原を交差提示できるかどうかを証明するために、マウスモデルにおいてDCの交差提示を証明する際に抗原特異的なOT-1 T細胞の分裂を指標として用いたように、ヒト細胞において交差提示を証明する同様のモデルを考案した。ヒトのMART-1癌抗原を発現させたaAVC-MART-1を作製した。更にOT-1の代わりにHLA-A2拘束性のMart-1癌抗原特異的TIL(tumor infiltrated lymphocytes)を準備した。このTILは、HLA-A2陽性のメラノーマ患者から樹立されたもので、MART-1抗原を認識するT細胞である。未熟DC(HLA-A2陽性)を投与したNOG免疫不全マウスにNKT細胞を輸注後、aAVC投与群と非投与群に分け、HLA-A2拘束性のTIL細胞をその後に投与することでT細胞の活性化を評価した。aAVC非投与群では、T細胞の分裂を認めなかったが、aAVC投与群では明らかなT細胞分裂を認めた。つまり、aAVCがNKT細胞に殺傷され、DCによりmRNA由来の抗原が提示されていることを示した。
(2)大動物を用いての薬理・薬効試験
細胞製剤を作製するにあたり、非げっ歯類である大動物を用いた有効性、安全性試験を行う必要がある。ヒトaAVC-ovaの細胞数を5x106 ,5x107の2群でイヌに免疫し、経時的にNKT細胞とT細胞の解析を行った。イヌNKT細胞の数はヒトの約1/10であるが、それにも関わらずaAVC-ovaの免疫後1~2週間で両群ともIFN-γ産生性のNKT細胞の数が増加することが判明した。更に血中IL-12の上昇(樹状細胞より産生)が認められた。T細胞の応答では、イヌのMHCは明らかになっていない為ペプチドは不明である。そこで、OVA蛋白を樹状細胞に導入させ、T細胞と共培養し、IFN-γ産生をELISPOT法で解析した。その結果抗原特異的にT細胞応答が認められることが判明した。安全性試験の点では、一般理学所見、腎機能、肝機能などの一般生化学検査、ウイルス検査、自己抗体測定などを行った。特に重篤な異常値を示すことはなかった。
以上のことから、ヒト型aAVCは抗原を生体内DCへ運ぶためのベクターとして働き、且つその細胞自体が最適なアジュバントを引き起こす誘導体になるため、宿主のHLA拘束性を考慮に入れる必要なく自然免疫と獲得免疫の両者を誘導できることになる。今回モデル抗原として卵白アルブミン(OVA)抗原と悪性黒色腫抗原(MART-1)mRNAを遺伝子導入し、その機能を実証したが、がんの種類に応じて腫瘍抗原を入れ替えると、多様ながんに適応可能である。従来の細胞療法は患者本人から血液を採取するオーダーメード療法だったため、医薬品としての開発が困難であった。しかし、人工アジュバントベクター細胞では、品質の安定化を図ることができ、医薬製剤化が期待できると考える。
***
参考文献
1. Fujii S, Shimizu K, Hemmi H, Steinman RM. Innate Vα14+ natural killer T cells mature dendritic cells, leading to strong adaptive immunity. Immunol Rev 2007; 220:183-98.
2. Fujii, S, Shimizu, K., Smith, C, Bonifaz, L. & Steinman, R.M. Activation of natural killer T cells by α-galactosylceramide rapidly induces the full maturation of dendritic cells in vivo and thereby acts as an adjuvant for combined CD4 and CD8 T cell immunity to a co-administered protein. J Exp Med 2003, 198:267-279..
3. Hermans IF, Silk JD, Gileadi U, Salio M, Mathew B, Ritter G, et al. NKT cells enhance CD4+ and CD8+ T cell responses to soluble antigen in vivo through direct interaction with dendritic cells. J Immunol 2003, 171:5140-7.
4. Fujii S, Liu K, Smith C, Bonito AJ & Steinman RM. The linkage of innate to adaptive immunity via maturing dendritic cells in vivo requires CD40 ligation in addition to antigen presentation and CD80/86 costimulation. J Exp Med 2004, 199:1607-1618.
5. Semmling V, Lukacs-Kornek V, Thaiss CA, Quast T, Hochheiser K, Panzer U et al. Alternative cross-priming through CCL17-CCR4-mediated attraction of CTLs toward NKT cell-licensed DCs.
Nat. Immunol. 2010; 11 313-320.
6. Shimizu K, Kurosawa Y, Taniguchi M, Steinman RM & Fujii S. Cross-presentation of glycolipid from tumor cells loaded with a-galactosylceramide leads to potent and long-lived T cell mediated immunity via dendritic cells. J Exp Med 2007, 204; 2641-2653.
7. Fujii S, Goto A, Shimizu K. Antigen mRNA-transfected, allogeneic fibroblasts loaded with NKT-cell ligand confer antitumor immunity. Blood 2009, 113:4262-72.
8. Shimizu K, Mizuno T, Shinga J, Asakura M, Kakimi K, Ishii Y, et al. Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Res 2013, 73:62-73.

