ホスファチジルイノシトール3,4,5-3リン酸(PIP3)は、シナプス構造可塑性誘導時に、スパイン上のspinuleの産生を制御する
Tweet執筆者情報
執筆者:上田善文
執筆者所属:(独)理化学研究所、脳科学総合研究センター記憶メカニズム研究室
現所属:金沢医科大学血液免疫以内科学、臨床研究棟
原著論文:PIP3 Regulates Spinule Formation in Dendritic Spines during Structural Long-Term Potentiation. The Journal of Neuroscience 33:11040-7, 2013.
更新日:2013年8月12日
概要
シナプスは、入力に応じてそのサイズを変化させるため、神経回路ネットワークに柔軟性を与え、記憶、学習に貢献する。しかしながら、シナプスの受け取り側の棘突起(スパイン)の形状がどのような因子によって制御されているかについては、依然としてわかっていない。本研究では、脂質セカンドメッセンジャー、ホスファチジルイノシトール-3,4,5-三リン酸(PIP3)が、グルタミン酸刺激依存的に、スパイン上のspinule(フィロポディア様突起物)の形成を制御することを証明し、さらにそのspinuleにPIP3が蓄積することを明らかにした。
はじめに
神経回路網において、シナプスは、記憶、学習の根底をなす最小素子と考えられている。故に、シナプスの振る舞いを明らかにすることは、記憶、学習を理解するうえで重要である。スパインは1μm3以下の微細な構造ではあるが、入力に応じてサイズを多様に変化させる。ダウン症や脆弱性X症候群などの精神遅滞を伴う病気においては、スパインの異常形態が観察されることからスパインの形と機能は密接に結びついていると考えられる(Fiala et al., 2002)。PIP3 は、グルタミン酸受容体シグナルの直下に位置し、Akt、WAVEなどと結合し細胞の形態、大きさなどに関与する。PIP3は、これらの下流のシグナル分子を、刺激依存的に膜におびき寄せ、そこで活性化させる。よって、PIP3の細胞内局在を調べることは、どこでこれらのシグナル伝達が起きているかを明らかにすることができる。そこで、本研究では、私たちが開発したPIP3蛍光寿命プローブを用い、単一のスパインにおいて、記憶学習の基礎となる構造可塑性を引き起こしたときに、脂質分子のスパイン内および樹状突起上での局在を観察し、さらにPIP3がスパインの構造に関与しているかを調べた。
実験方法
・スパインにシナプス構造可塑性を誘導する方法
近年、二光子顕微鏡下でグルタミン酸をマスクしたcaged-グルタミン酸にphotouncagingを施す事で、局所にグルタミン酸を産生させ、一つのスパインにおいて構造可塑性を誘導することが可能となった(Matsuzaki et al., 2004)。構造可塑性を誘導すると、スパインは速やかに大きくなり、数時間後も、刺激前に比べて大きいサイズを維持することから記憶のモデルと考えられている。
・スパインでのPIP3を観察する方法
私たちは、蛍光共鳴エネルギー移動(FRET)を基にしたDAGおよびPIP3の蛍光プローブを開発し、培養細胞レベルで脂質分子の動態を明らかにしてきた(Sato et al., 2003; Sato et al., 2006)。本研究では、神経回路網がin vivoの特異性を維持しているラット海馬スライスを用いるために、組織内でも精度良くFRETを測定できる蛍光寿命プローブ(FLIMPA3)に改良した(図1)。GFPをドナー、蛍光を発しないアクセプターDark-Venus、PIP3に結合するPHドメインをプローブに導入する。GFP-PHドメイン-Dark-Venus間を剛直な、αヘリックスで連結し、このヘリックスにGly-Glyを1箇所導入することによって、ここを起点にプローブが回転できるようにした。さらにN-ras膜局在シグナルを用いて細胞膜にプローブを局在させた。細胞膜内でPIP3が産生されるとPHドメインに結合し、GFP、Dark-Venus間の距離及び相対的配向の変化によって蛍光寿命が変化する。結合した状態では、FRETが起き、蛍光寿命は短くなる。この原理に従って、PIP3の増減を可視化、定量する。
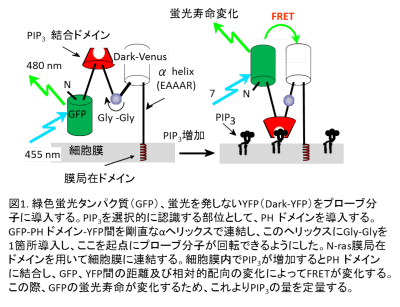
海馬神経細胞におけるPIP3の細胞内局在
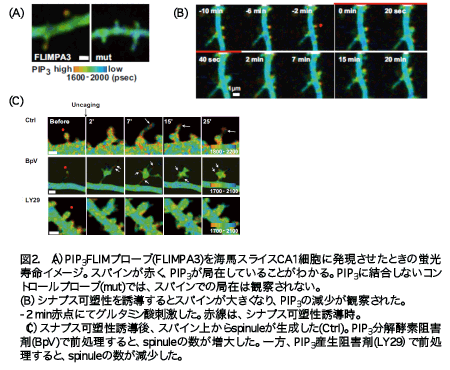
海馬スライスCA1錐体細胞に遺伝子銃によって、PIP3プローブを導入し、翌日、PIP3の細胞内局在を観察したところ、樹状突起に比べて、スパインに局在していることがわかった(図2A)。何故、このような細胞内分布をしているのかをPIP3産生および分解酵素の阻害剤を用いて検討した。PIP3の産生酵素PI3Kの阻害剤を加えると、樹状突起よりも、スパインにおいて、PIP3の減少が起きた。これは、PIP3産生酵素の活性が、スパインにおいて高いことを示している。過去の論文において、PIP3産生酵素は、スパイン、樹状突起両方に存在するが、スパインに存在するAMAP受容体と結合し、そこで、高い活性を保っていることが報告されている(Man et al., 2003)。 また、PIP3分解酵素PTENの阻害剤を加えると、PIP3は、スパインよりも樹状突起において増加することがわかった。これは、PIP3代謝酵素の活性が樹状突起に存在していることを示している。PIP3代謝酵素がスパインよりも樹状突起に存在することが示されている(van Diepen et al., 2009)。これらの結果より、PIP3がスパインに局在しているのは、PIP3産生酵素PI3Kがスパインで活性が高く、分解酵素PTENが樹状突起に存在することから生じることがわかった。
シナプス可塑性誘導時のPIP3のスパイン内変化
シナプス構造可塑性をスパインに与えたところ、スパインに始めから存在したPIP3が速やかに消去されることがわかった。PIP3の減少の程度は、刺激前の樹状突起とスパインのPIP3の濃度差とよく相関した。この結果は、スパインのサイズが大きくなるに従って、PIP3の濃度が低い樹状突起からの膜の流入によって、刺激前にあったPIP3が薄まった結果であることを示している。
次に、薄まったPIP3がスパインのどこに局在しているかを調べるために、スパイン内のPIP3の局在を調べた。スパインは、シナプス構造可塑性誘導時に、単純にその大きさを変えるだけでなく、spinule構造(フィロポディア様突起物)を形成する。SpinuleとspineのPIP3の濃度を比較したところ、PIP3は、spinuleにおいて、より蓄積していることが分かった。つまり、PIP3はスパインで減少し、spinuleで増加する (図2B,C)。
PIP3は、スパインでのspinule構造産生を制御する
さらに、PIP3のスパインの構造に対する影響を検討した。 PIP3産生酵素PTENの阻害剤を用いてスパインのPIP3濃度を増やした後に、シナプス構造可塑性を誘導したところ、spinuleが異常形成された。PIP3産生酵素の阻害剤を用いて、PIP3の量を減らした際には、シナプス構造可塑性誘導後、spinuleの構造は、ほとんど起きなくなった。これより、PIP3は、刺激依存的に、spinuleの産生を上げることがわかった(図2C)。
Discussion
電子顕微鏡によって、スパイン上、シナプス後肥厚部の隙間からspinuleが産生していることが報告されている(Spacek and Harris, 2004)。また、グルタミン酸刺激、電気的なテタヌス刺激、高濃度のカリウム刺激によって、spinuleが産生することが知られている(Toni et al., 1999; Richards et al., 2005; Tao-Cheng et al., 2009)。さらに、シナプス結合を形成しているシナプス前膜の中にspinuleが取り込まれ、ちぎれた破片が存在することが報告されている(Spacek and Harris, 2004)。Spinuleの意義は、2つ考えられている。一つは、シナプス後肥厚部を再構成するために、余分な膜として除かれる説。もう一つは、シナプス前膜に取り込まれたspinuleが、逆行性のシグナルとして働いている可能性があるという説である(Spacek and Harris, 2004)。私たちの研究において、グルタミン酸刺激を受けたスパインは、spinuleを形成し、そこにPIP3が蓄積することがわかった。これは、電子顕微鏡の研究から提唱されているスパインからspinuleが伸び、シナプス前膜に取り込まれ、そこで、PIP3がシグナル分子として機能し、シナプスの結合の強化を誘導している可能性がある。
参考文献
Fiala JC, Spacek J, Harris KM (2002) Dendritic spine pathology: cause or consequence of neurological disorders? Brain Res Brain Res Rev 39:29-54.
Man HY, Wang Q, Lu WY, Ju W, Ahmadian G, Liu L, D'Souza S, Wong TP, Taghibiglou C, Lu J, Becker LE, Pei L, Liu F, Wymann MP, MacDonald JF, Wang YT (2003) Activation of PI3-kinase is required for AMPA receptor insertion during LTP of mEPSCs in cultured hippocampal neurons. Neuron 38:611-624.
Matsuzaki M, Honkura N, Ellis-Davies GC, Kasai H (2004) Structural basis of long-term potentiation in single dendritic spines. Nature 429:761-766.
Richards DA, Mateos JM, Hugel S, de Paola V, Caroni P, Gahwiler BH, McKinney RA (2005) Glutamate induces the rapid formation of spine head protrusions in hippocampal slice cultures. Proc Natl Acad Sci U S A 102:6166-6171.
Sato M, Ueda Y, Umezawa Y (2006) Imaging diacylglycerol dynamics at organelle membranes. Nat Methods 3:797-799.
Sato M, Ueda Y, Takagi T, Umezawa Y (2003) Production of PtdInsP3 at endomembranes is triggered by receptor endocytosis. Nat Cell Biol 5:1016-1022.
Spacek J, Harris KM (2004) Trans-endocytosis via spinules in adult rat hippocampus. J Neurosci 24:4233-4241.
Tao-Cheng JH, Dosemeci A, Gallant PE, Miller S, Galbraith JA, Winters CA, Azzam R, Reese TS (2009) Rapid turnover of spinules at synaptic terminals. Neuroscience 160:42-50.
Toni N, Buchs PA, Nikonenko I, Bron CR, Muller D (1999) LTP promotes formation of multiple spine synapses between a single axon terminal and a dendrite. Nature 402:421-425.
van Diepen MT, Parsons M, Downes CP, Leslie NR, Hindges R, Eickholt BJ (2009) MyosinV controls PTEN function and neuronal cell size. Nat Cell Biol 11:1191-1196.

