ヒト脂肪由来間葉系幹細胞における効率的かつ厳密に発現制御可能なレンチウイルス発現システムの構築
Tweet執筆者情報
執筆者:森山博由、森山麻里子、早川堯夫
執筆者所属:近畿大学 薬学総合研究所 先端バイオ医薬研究室(Lab of Advanced Biomedicinal Products, Pharmaceutical research and Technology Institute, KINKI UNIVERSITY)
原著論文:Tightly regulated and homogeneous transgene expression in human adipose-derived mesenchymal stem cells by lentivirus with tet-off system. PLoS ONE 12:e66274, 2013.
更新日:2013年9月18日
概要
ヒト脂肪組織中には、間葉系幹細胞(脂肪組織由来幹細胞:ASC)が含まれている。ヒト生体より低侵襲にて安全に採取できるASCは、極めて高い分化能力、組織修復能力、低い免疫原性など、臨床応用に適した潜在能力を有する細胞である。そこで我々は、更なるASCの有用性を高め、かつ、その性状解析にも有効に機能する遺伝子改変ASC樹立を目指し、効率的かつ厳密に制御可能なレンチウイルス発現システムの構築に至った。
研究内容
間葉系幹細胞(mesenchymal stem cell: MSC)は、骨髄、脂肪、臍帯血などに存在することが知られており、脂肪、骨、軟骨のみならず、神経、肝細胞、インスリン産生細胞、心筋を含むさまざまな細胞へ分化する能力を持つ[1]。また、創傷部位への高い遊走能力、各種成長因子分泌による組織修復能力、さらには免疫拒絶回避能力も持つことが報告されていることから、再生医療におけるあらたな細胞供給源として高い注目を集めている[2]。
その中でも、脂肪組織由来間葉系幹細胞(ASC)は、そのもととなる脂肪組織が安全かつ簡易に採取できることのみならず、美容整形や形成外科領域における手術時に余剰医療廃棄物として大量に得ることが可能であり、倫理的懸念も極めて少ない。このような理由から、細胞治療用、組織構築用、遺伝子治療用等、様々な臨床応用の素材としてASCに寄せられる期待は大きい[3]。その期待に付託するために、効率的かつ厳密に制御可能な遺伝子改変ASCを樹立することによって、ASCの基礎から臨床研究を強力に推進する研究ツールを整備することが必要不可欠である。
数ある遺伝子導入法がある中で、レンチウイルスベクターを用いた方法は、導入効率が高いうえ、外来遺伝子がゲノムに組み込まれるために安定的かつ長期的な遺伝子発現が望めることより、ヒト初代細胞に対して有効なものの一つである。しかし、CMVプロモーターのような強いプロモーターを使用することによって、ES細胞や骨髄由来MSCでは遺伝子サイレンシングが起こることも報告されている[4,5]。それゆえ、ASCでサイレンシングの起こりにくいプロモーターを選択することが、遺伝子改変ASCの樹立には不可避だと思われた。
ASCで安定的に働くプロモーターの選択と同時に必要なのが、導入遺伝子の時間的制御である。例えば、ある分化細胞が大量に必要となったとしよう。分化した細胞は基本的に増殖しないため、大量のASCを増やしてから分化に必要な転写因子を導入する必要があり、その苦労は想像するに難くない。しかし、もし導入遺伝子の時間的制御が可能であれば、分化するために必要な転写因子を組み込んだASCを樹立し、必要な細胞数まで増やしてから導入遺伝子の発現をオンにすると、大量の分化細胞を効率的に得ることができる。導入遺伝子の時間的制御を可能とするテトラサイクリン誘導システム(Tet-offシステム)は、遺伝子治療においても高い実績がある[6]。
しかしながら、従前のシステムは最低2つの発現制御ユニットが必要である。1つはテトラサイクリン制御性トランス活性化因子(tTA)を恒常的に発現させるユニット、もう一つはテトラサイクリン応答因子(TRE)をコードし、目的遺伝子を下流につないだ応答ユニットである。このユニットを別々のコンストラクトとして導入することは、時間的ロスにもつながり、初発細胞数や継代数の限られた初代細胞にはあまり適さない方法である。そこで最近では、これらのユニットを一つのウイルスベクターコンストラクトにまとめようと試みる研究者も多いが、有用性の高いレンチウイルスベクターではプラスミドサイズが障壁ととなり、高いウイルス力価が得られにくい、抗生物質耐性遺伝子などによる選択マーカーが欠如しているなど、改良課題が積み残されている現状がある。
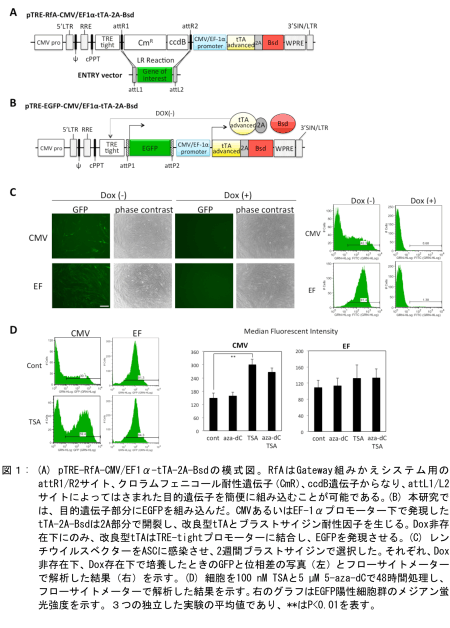
そこで、我々は上記の欠点を回避したうえで、ASCにおいて極めて安定的に発現するASCに至適化したテトラサイクリン誘導型レンチウイルス発現システムを構築した。今回構築したコンストラクトを図1Aに示す。このコンストラクトはTRE-Tightをコードした応答ユニットの直下に、CMVあるいはEF-1αプロモーターによって制御された改良型tTA(tTA advanced)を発現するユニットが存在する。この改良型tTAには、Thosea asigna virus由来の2A配列を介してブラストサイジン耐性遺伝子(Bsd)をつないでおり、改良型tTAとBsdは単一mRNAとして転写されるが、翻訳される際に2A配列中で分断され、結果として改良型tTAとBsdタンパク質が生成する。テトラサイクリンの誘導体であるドキシサイクリン(Dox)非存在下においてのみ、この改良型tTAがTRE-Tightプロモーターに結合し、目的遺伝子の発現を誘導することが可能となる。TRE-Tightプロモーター下流には、Gatewayシステムを用い、大腸菌内で簡便に目的遺伝子を組みかえることが可能である。ASCにおける、このコンストラクトの有効性を調べるために、Gatewayシステムで目的遺伝子としてEGFPを組みかえ、pTRE-EGFP-CMV-tTA-2A-BsdならびにpTRE-EGFP-EF-tTA-2A-Bsdを構築し(図1B)、このコンストラクトからレンチウイルスベクターを作成した。
このレンチウイルスベクターをASCに感染させ、4 μg/mLのブラストサイジンで選択を行った。非感染コントロールのASCは1週間で全滅したが、これらのレンチウイルスベクターを感染させたASCは生存し、増殖を続けた。また、図1Cに示したように、Dox非存在下においてのみ、EGFPの発現が確認された。しかし、pTRE-EGFP-EF-tTA-2A-Bsdを感染したASCでは、ほぼ100%の細胞でEGFPの発現が確認されたのに対し、pTRE-EGFP-CMV-tTA-2A-Bsdを感染したASCでは、50%以上のASCがEGFP陰性であり、なおかつEGFP発現量も細胞によってまちまちであるという結果となってしまった(図1C)。これはしばしば2つの発現ユニットが並んで配列されているときに見られる「プロモーター抑制(promoter suppression)」と呼ばれる現象であることが予想された[7,8]。
この場合、隣接したユニットによるCpGのメチル化やヒストン脱アセチル化などのエピジェネティックな抑制が起こっていると報告されている。そこで、pTRE-EGFP-CMV-tTA-2A-Bsdを感染したASCに、ヒストン脱アセチル化酵素阻害剤であるTrichostatin A (TSA)ならびに脱メチル化剤である5-Aza-deoxycytosine (5-Aza-dC)を作用させ、EGFPの発現が回復するかどうか確認した。すると、TSAを作用させた場合にのみ、EGFP陽性細胞が有意に増加したことから、pTRE-EGFP-CMV-tTA-2A-Bsdは、ヒストン脱アセチル化による遺伝子サイレンシングを受けていることが示唆された(図1E)。
以上の結果より、TRE-Tightプロモーター下の目的遺伝子を効率的に発現させるためには、EF-1αプロモーターによってtTA-2A-Bsdを発現させた方が、遺伝子サイレンシングに耐性であることが判明した。なお、当該論文中ではCMVプロモーターならびにEF-1αプロモーターより直接EGFPを発現させるレンチウイルスベクターを作成し、ASCでの発現効率を確認しているが、この場合にもCMVプロモーター使用時には遺伝子サイレンシングが起こり、EGFPの発現量が低下していくのに対し、EF-1αプロモーター使用時には最大4週間までサイレンシングが起こらないことを確認しているので参照されたい。
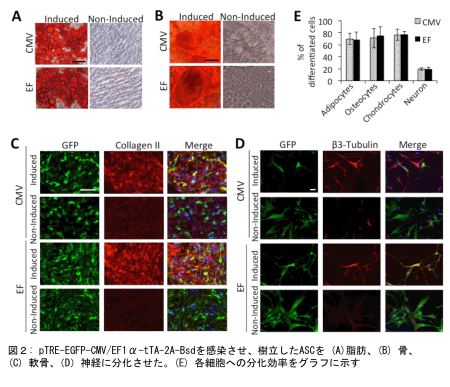
以上の結果より、我々の構築した単一tet-offレンチウイルス発現子発現システムはASCのみならず、他のMSCやES、iPSをはじめとした細胞の再生医療応用をすすめる重要なツールとなり得ると言える。このレンチウイルスベクターを感染させたASCは、その幹細胞機能を失わず、脂肪、骨、軟骨、神経へと効率的に分化した(図2)ことからも、この発現システムは十分に機能することはもとより、今後の様々な研究への展開と応用が期待される。
参考文献
1. Okura H, Komoda H, Fumimoto Y, Lee CM, Nishida T, et al. (2009) Transdifferentiation of human adipose tissue-derived stromal cells into insulin-producing clusters. J Artif Organs 12: 123-130.
2. Moriyama M, Moriyama H, Ueda A, Nishibata Y, Okura H, et al. (2012) Human adipose tissue-derived multilineage progenitor cells exposed to oxidative stress induce neurite outgrowth in PC12 cells through p38 MAPK signaling. BMC Cell Biol 13: 21.
3. Chan J, O'Donoghue K, de la Fuente J, Roberts IA, Kumar S, et al. (2005) Human fetal mesenchymal stem cells as vehicles for gene delivery. Stem Cells 23: 93-102.
4. Qin JY, Zhang L, Clift KL, Hulur I, Xiang AP, et al. (2010) Systematic comparison of constitutive promoters and the doxycycline-inducible promoter. PLoS One 5: e10611.
5. Kim S, Kim GJ, Miyoshi H, Moon SH, Ahn SE, et al. (2007) Efficiency of the elongation factor-1alpha promoter in mammalian embryonic stem cells using lentiviral gene delivery systems. Stem Cells Dev 16: 537-545.
6. Weber W, Fussenegger M (2006) Pharmacologic transgene control systems for gene therapy. J Gene Med 8: 535-556.
7. Villemure JF, Savard N, Belmaaza A (2001) Promoter suppression in cultured mammalian cells can be blocked by the chicken beta-globin chromatin insulator 5'HS4 and matrix/scaffold attachment regions. J Mol Biol 312: 963-974.
8. Emerman M, Temin HM (1986) Comparison of promoter suppression in avian and murine retrovirus vectors. Nucleic Acids Res 14: 9381-9396.

