�V���X�^�]�[���̓����t�@�����ɂ��o�����[�ǂ̑��������P������
Tweet���M�ҏ��
���M�ҁF�k���i�P�A�]���S��A�O��\�S�A��ؗI�N��A�ɓ��G�L�A�ߊԈꊰ�A���V����A���p��
���M�ҏ����F��ȑ�w��w�@�@���̋@�\��͊w��u���@�����͊w������
�����_���FCilostazol ameliorates warfarin-induced hemorrhagic transformation after cerebral ischemia in mice. Stroke 44:2862-2868 2013.
�X�V���F2013�N12��11��
�T�v
���݁A�o�����[�ǂɑ���L���Ȏ��Ö@�͂Ȃ��A�����t�@�����ɂ��o�����[�ǂ̑���͒v���I�ł��邽�߁A���̎��Ö@�̊m�����s���ł���B�R������ł���V���X�^�]�[���͐_�o�ی��p����ь��Ǔ���זE�ی��p���܂ޗl�X�ȕی��p��L���邱�Ƃ��m���Ă��邪�A�����t�@�������p���҂ɂ͐T�d���^�Ƃ���Ă���B�{�����ł́A�V���X�^�]�[����Tight junction proteins�����VE-cadherin�����邱�ƂŁA�����t�@�����ɂ��o�����[�ǂ̑�����}�����邱�Ƃ𖾂炩�ɂ����B�܂��A��������̏o�����Ԃ����������Ȃ��������Ƃ���A�{�������Տ��ɉ��p�ł���\�����������ꂽ�B
�����t�@�����R�ÌŗÖ@
�]�����͔N��ɑ傫���֗^���Ă���B��i���ɂ����鍂��ɂ���āA�S�����]�ǐ��ǂ̎�Ȍ����ł����ٖ��ǐ��S�[�ד��ɂ��]�[�NJ��Ґ���2030�N�܂ł�2�{�ɂȂ邱�Ƃ��\������Ă���B
�o���R�ÌŖ�̓��^�͍L���F�߂��Ă���A���ɍ������A���A�a�A�s������]�[�Ǘ�������A�����ǂ̊댯�����������҂ɂ�����A��ٖ��ǐ��S�[�ד��ɂ��]�[�ǂ̗\�h�̂��߂̕W���I�Ȏ��ÂƂ��ċ����i�߂��Ă���B1, 2
�r�^�~��K�̃A���^�S�j�X�g�ł��郏���t�@�����́A��ٖ��ǐ��S�[�ד����҂̐S�����]�ǐ��Ǘ\�h�̑��I���Ƃ��āA�Տ���L���p�����Ă���B���̐V�K�o���R�ÌŖ�A���Ƀ_�r�K�g������o���L�T�o���̓����t�@�����ɔ�ׂďo�������ǂ���r�I���Ȃ����A3, 4 ���ٓI�ȃA���^�S�j�X�g���Ȃ��A�o�����N�������ۂɂ��̍�p���y�����邱�Ƃ��ł��Ȃ����Ƃ��Տ��ŗp�������Ŏ�Ȍ��O�ƂȂ��Ă���B5�@����́A�����t�@�����͗Տ��ɂ����ĕW���I�Ȍo���R�ÌŖ�Ƃ��Ďg��ꑱ���Ă���B
�����̏o�����ω��͔]�[�ǂ̍����ǂƂ��Đ����A������Q��S�����]�ǐ��ǂ̑傫����������̑����o�����ω��̓Ɨ��������X�N�t�@�N�^�[�Ƃ��Č���Â����Ă���B6�@����ɔ]������̑����o�����ω��̐[���ȃT�u�^�C�v�ł����������͊��҂Ɉ����]�A�������炷�B�������A���ݗՏ��ɂ����ďo�����[�ǂ�\�h���邽�߂ɗ��p�ł���L���Ȏ��Ö@�͂Ȃ��B�o�����[�ǂ̎�Ȍ�����1�Ƃ��āA����܂łɔ]�����̎����I�����ɂ���āA�����ğ�̌��t�]�֖� (BBB) �̓��ߐ��̏㏸���֗^���Ă��邱�Ƃ����炩�ɂ���Ă��Ă���B7 �����t�@�����R�ÌŗÖ@���҂ɂ�����o�����[�ǂ̃��X�N�Ɋւ��錤���͖������܂�Ȃ����A�}�E�X�ɂ����Ă̓����t�@�����̑O���u����ߐ��]������̏o�����ω��̃��X�N�傳���邱�Ƃ�������Ă���B8
�V���X�^�]�[���̕ی��p
�V���X�^�]�[���̓z�X�z�W�G�X�e���[�[�V�j�Q��p��L����R������ł���A�]�[�ǂ�2���\�h����і������������ɂ�����Ԍ�����s�ɍL���p�����Ă���B�V���X�^�]�[���̓�����1�͌��Ǔ���זE����ݓI�ɕی삷�邱�Ƃł���B��X�͉ߋ��Ƀ}�E�X�ɂ����ăV���X�^�]�[����BBB�̔j�]��h�����ƂŁA�]������̏o�����[�ǂ����������邱�Ƃ𖾂炩�ɂ��Ă����B7, 9
�����Ŗ{�����́A�]������̃����t�@�����U���o�����[�ǂ̗}���ɑ���V���X�^�]�[���̍�p�𖾂炩�ɂ��邱�Ƃ�ړI�ɍs�����B
�����t�@�����U���o�����[�ǃ��f���̍쐻
�����t�@�����𐅃r���ɓ���A���R�������Ń}�E�X�����炵�A�o���I�Ɍ��t���̎悷�邱�ƂŁA���t�ÌŔ\�̎w�W�ł���prothrombin time-international normalized ratio (PT-INR) �𑪒肵���B���̌��ʁA�����t�@�������^�J�n18���Ԍ��PT-INR���Տ��ł̎��È�ɒB�������߁A���ヂ�f�����쐻�����ŁA�����t�@�������^���Ԃ�18���Ԃɐݒ肵���B�����t�@�������^18���Ԍ�ɁA3���ԋ���/�ğ��{�����Ƃɂ��o�����[�ǂ������N�����A�����t�@�����U���o�����[�ǃ��f�����쐻�����B
�����t�@�����U���o�����[�ǃ��f���ɑ���V���X�^�]�[���̏o���ɋy�ڂ��e��
�{���f���}�E�X��p���āA�ğ���ɍ[�Ǒ̐ς�ω������Ȃ��ʂ̃V���X�^�]�[�� (1�܂���3 mg/kg) �o���ɓ��^�����B�o���ʂ̓w���O���r���A�b�Z�C�ɂ���Ē�ʂ����B�����t�@�����P�Ɠ��^�Q�ŏo���ʂ����������̂ɑ��A�V���X�^�]�[�����p�Q�ł͂��ꂪ�}�����ꂽ�B(�}1A-C) �܂��A7����܂ł̐��������]�������Ƃ���A�����t�@�����P�Ɠ��^�Q�����V���X�^�]�[�����p�Q�ɂ����ėL�ӂɐ����������������B(�}1D)
���ɁA�����t�@�����ƃV���X�^�]�[���̏o���ɑ��鑊�ݍ�p���������邽�߁A�C�\�t�������������ŐK���̒��a��2.5 mm�̏ꏊ�̔��Ö���؊J���A�N�o���錌�t��30�b���ɂ뎆�ŋz�����A���R�Ɏ~������܂ł̎��Ԃ𑪒肵���B�����t�@�����P�Ɠ��^�Q�ƃV���X�^�]�[�����p�Q�̏o�����ԂɗL�ӂȍ��͂Ȃ������B(�}1E)
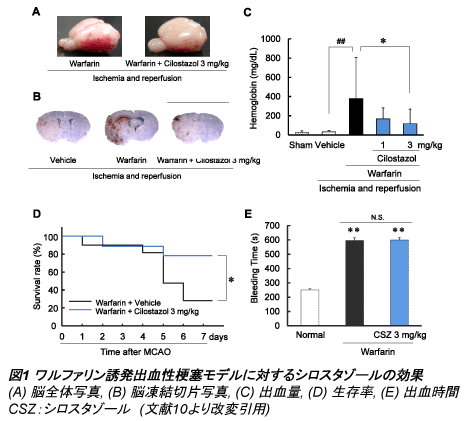
�V���X�^�]�[���̏o�����[�Ǘ}�����J�j�Y���̌���
���ɁA�V���X�^�]�[���������t�@�����ɂ��o����}���������J�j�Y���̉𖾂�ړI�ɁABBB�̃o���A�[�@�\��1�ł���Tight junction proteins (TJPs) �ɒ��ڂ����BTJPs�͖��ђʌ^�^���p�N����Claudin, Occludin�����JAM���琬��A�����̃^���p�N����ZO-1����čזE����actin�ɘA�����Ă���A����Claudin-5, Occludin�����ZO-1��BBB�̏d�v�ȍ\�����q�ł���B����č���ATJPs�ł���Claudin-5, Occludin, ZO-1�����Adherens junction protein�ł���VE-cadherin�̃^���p�N�ʂ��E�G�X�^���u���b�g�ɂ�葪�肵���B�V���X�^�]�[���́A�����ɂ��ZO-1�AClaudin-5�����VE-cadherin�̔����̌�����}�������B(�}2)
���ɁA�ߏ�Ȕ������]������̕����яo���Ɋ֗^����ƍl�����Ă���Matrix metalloproteinase (MMP) -2�����9�ɂ��Ă��������s�������A�����t�@�����P�Ɠ��^�Q�ƃV���X�^�]�[�����p�Q�̊ԂɗL�ӂȍ��͔F�߂��Ȃ������B
�ȏ�A�V���X�^�]�[���������t�@�����ɂ��o�����[�ǂ�}�������@���Ƃ��āAMMP-2�����9�͊֗^�����A�����ɂ��TJPs�����VE-cadherin�̌�����}���������Ƃ��������ꂽ�B���Ȃ킿�A�V���X�^�]�[����MMP-2,9������A����TJPs�����VE-cadherin��ی삵�Ă���\�����������ꂽ�B
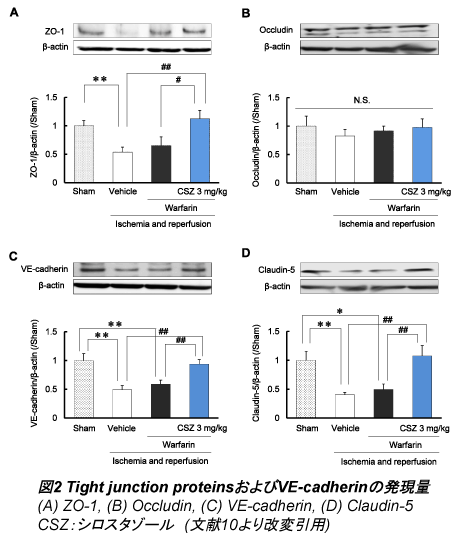
�����̌��ʂ���A�V���X�^�]�[���������t�@�����ɂ��o�����[�ǂ̑�����}������\�����������ꂽ�B�܂��A���̍�p�@���Ƃ��āA�V���X�^�]�[���������ɂ��TJPs��VE-cadherin�̒ቺ��}�����邱�Ƃ��l������B�܂��A�����t�@�����ƃV���X�^�]�[���p���Ă��A��������̏o�����Ԃ����������Ȃ��������Ƃ���A�Տ��ɂ����p���邱�Ƃ��ł���\�����������ꂽ�B
�Q�l����
1) Hart RG, Pearce LA, Aguilar MI. Meta-analysis: Antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 2007;146:857-867
2) Furie KL, Kasner SE, Adams RJ, Albers GW, Bush RL, Fagan SC, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: A guideline for healthcare professionals from the american heart association/american stroke association. Stroke. 2011;42:227-276
3) Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139-1151
4) Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883-891
5) Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy: Current practices and unresolved questions. Stroke. 2006;37:256-262
6) Paciaroni M, Agnelli G, Corea F, Ageno W, Alberti A, Lanari A, et al. Early hemorrhagic transformation of brain infarction: Rate, predictive factors, and influence on clinical outcome: Results of a prospective multicenter study. Stroke. 2008;39:2249-2256
7) Nonaka Y, Tsuruma K, Shimazawa M, Yoshimura S, Iwama T, Hara H. Cilostazol protects against hemorrhagic transformation in mice transient focal cerebral ischemia-induced brain damage. Neurosci Lett. 2009;452:156-161
8) Pfeilschifter W, Spitzer D, Czech-Zechmeister B, Steinmetz H, Foerch C. Increased risk of hemorrhagic transformation in ischemic stroke occurring during warfarin anticoagulation: An experimental study in mice. Stroke. 2011;42:1116-1121
9) Ishiguro M, Mishiro K, Fujiwara Y, Chen H, Izuta H, Tsuruma K, et al. Phosphodiesterase-iii inhibitor prevents hemorrhagic transformation induced by focal cerebral ischemia in mice treated with tpa. PLoS One. 2010;5:e15178
10) Kitashoji A, Egashira Y, Mishiro K, Suzuki Y, Ito H, Tsuruma K, et al. Cilostazol ameliorates warfarin-induced hemorrhagic transformation after cerebral ischemia in mice. Stroke. 2013;44:2862-2868

