父性遺伝する食事性肥満
Tweet執筆者情報
執筆者:森田純代、堀居拓郎、木村美香、荒井勇二、亀井康富、小川佳宏、畑田出穂
連絡先:畑田出穂、〒371-8512群馬県前橋市昭和町3-39-15 群馬大学 生体調節研究所ゲノム科学リソース分野 教授 hatada@gunma-u.ac.jp
原著論文:Paternal Allele Influences High Fat Diet-Induced Obesity. PLoS One 9: e85477, 2014.
更新日:2014年1月24日
概要
C57BL/6J (B6)マウスは高脂肪食を食べさせることにより肥満になりやすいが、その遺伝的背景についてはわかっていない。今回我々はこの食事誘導性の肥満が父親からのみ遺伝することと、この現象が父性インプリント遺伝子のIgf2, Peg3の発現と関係していることを報告する。
はじめに
哺乳類において父と母由来のゲノムは等価でない。これはゲノムインプリンティング(ゲノム刷り込み)が存在し、インプリント遺伝子という父親由来アレル特異的あるいは母親由来アレル特異的な発現を示す遺伝子があることによる。インプリント遺伝子の中には肥満に関係するものが多く知られており、例えばPrader-Willi症候群という肥満を伴う疾患の責任遺伝子はインプリント遺伝子である(Butle, 2011)。またPeg1、Dlk1、Peg3といった遺伝子も肥満と関係している。その他、脂肪の分化と関係しているものも知られている。
C57BL/6J (B6)マウスは高脂肪食により肥満や2型の糖尿病になりやすく(Surwit et al., 1988) 、長年代謝研究に用いられてきた。AKR/JやDBA/2Jマウスも同様に食事誘導性肥満になりやすいが、それに対してA/J 、KsJ、 SWR/Jは食事誘導性肥満になりにくい。今回の研究では、PWKマウスが食事誘導性肥満になりにくいことを見い出した。そして食事誘導性肥満になりやすいB6とPWKを交互に交配して(PWK×B6) F1と(B6×PWK) F1の2種類のF1をつくり肥満とインプリンティングの関係について調べた。
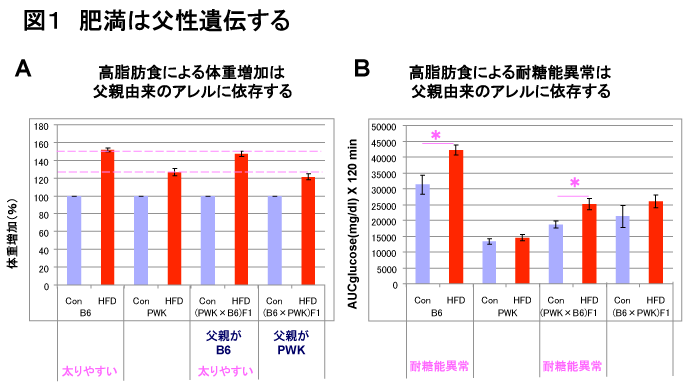
食事誘導性肥満は父性遺伝する
C57BL/6J (B6)マウスは食事性誘導肥満になりやすく、PWKマウスは食事誘導導性の肥満になりにくい。これらのマウスをかけ合わせてF1をつくったところB6が父親のとき、すなわち(PWK×B6) F1は食事性誘導肥満になりやすいが、PWKが父親のときは、すなわち(B6×PWK) F1は食事性誘導肥満になりにくかった(図1A)。つまり食事性誘導肥満は父性遺伝することがわかった。またB6マウスは耐糖能異常を示すが、同じようにF1調べてみたところB6が父親のときのみで耐糖能異常を示し、PWKが父親のときは耐糖能異常がみられなかった。すなわち耐糖能異常も父性遺伝することがわかった(図1B)。
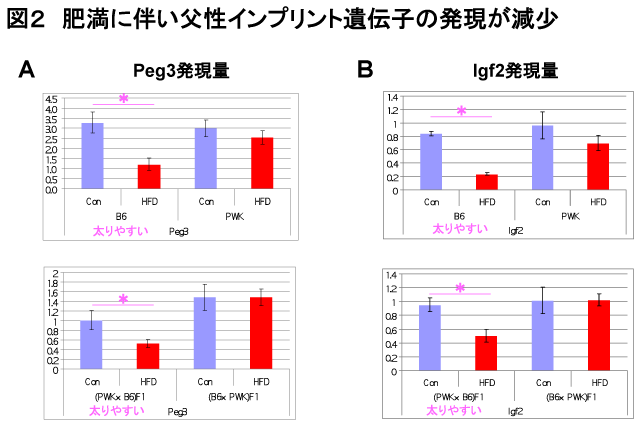
食事性肥満により白色脂肪のインプリント遺伝子の発現が変化する
インプリンティングとは遺伝子発現が由来する親が父であるか母であるかにより発現が異なる現象をいう。父性インプリント遺伝子は父親由来のアレルのみ発現し、母性インプリント遺伝子は母親由来のアレルのみ発現する。これらの遺伝子の中には肥満や脂肪の分化に関係しているものも多く知られている。そこで父性遺伝する食事性誘導肥満がインプリント遺伝子の発現と関係していると考え、B6とPWKの白色脂肪におけるインプリント遺伝子の発現を調べた。その結果、父性発現遺伝子のPeg3と Igf2の発現が高脂肪食を食べさせることによりB6でのみ発現が減少していた(図2)。また母性発現遺伝子のIgf2rの発現がB6でのみ高脂肪食を食べさせることにより発現が上昇していた。さらに興味深いことにF1の白色脂肪で発現を調べたところB6が父親のとき、すなわち(PWK×B6) F1はPeg3とIgf2の発現が高脂肪食を食べさせることにより減少するが、PWKが父親のとき、すなわち(B6×PWK) F1はPeg3とIgf2の発現が減少しなかった(図2)。すなわち食事性肥満の父性遺伝に伴ってインプリント遺伝子の発現が変化することがわかった。母性発現遺伝子のIgf2rはF1で発現の変化はなかった。
Peg3とIgf2のDNAメチル化は変化がない
インプリント遺伝子では父母のアレルでDNAメチル化が異なる領域がありDifferentially Methylated Region (DMR)と呼ぶが、これはアレル特異的な発現と関連している。そこで高脂肪食を食べさせることによりおこった発現の変化には、DNAメチル化の変化が関与しているのではないかと考え白色脂肪でのDNAメチル化状態を調べた。しかしながらDNAメチル化には変化がなく、発現の変化は他の機構によるものと考えられる。
Igf2はTNF-alphaによる炎症作用から白色脂肪を守っている
近年、肥満は白色脂肪の慢性炎症と密接に関連していることがわかってきた(Cinti et al., 2005)。脂肪組織へのマクロファージの集積は体重の増加、脂肪の炎症、インスリン感受性の低下と関連している。肥満したマウスの白色脂肪では炎症性ケモカインであるMCP-1の分泌が増え、マクロファージが遊走してきて、炎症性のサイトカインであるTNF-alphaの分泌を促進する。それにより脂肪細胞の炎症は増悪し脂肪のインスリン感受性の低下がもたらされる(De Taeye et al., 2007)。さらにMCP-1の分泌が増えるとともに、インスリン受容体の感受性を良くするアディポネクチン(Ravussin, 2002)の分泌が減少する。
我々はIgf2が脂肪細胞にどのような影響を与えるかを白色脂肪細胞のモデルである3T3-L1細胞で調べた。その結果Igf2の添加によりTNF-alphaによるMCP-1の発現増加、アディポネクチンやグルコーストランスポーターであるGlut4の発現減少を抑えることができた。さらにIgf2はTNF-alphaによるインスリン依存的な糖取り込みの減少も抑えることができた。以上のことからIgf2はその抗炎症作用により肥満を抑制していることが示唆された。このような効果はPeg3ではみられなかった。
Discussion
今回の研究で食事誘導性肥満感受性のB6と耐性のPWKをかけあわせたところF1ではB6が父親のときのみ食事誘導性肥満になった。このことから食事誘導性肥満は父性遺伝しインプリント遺伝子の関与が推測された。そこで肥満したマウスの白色脂肪におけるインプリント遺伝子の発現を調べたところ父性発現のインプリント遺伝子Peg3と Igf2の発現が減少していた。この現象がおこる原因としては(1)これらの遺伝子の転写調節領域のB6とPWKの多型によるのか、(2)これらの遺伝子の発現を制御する父性発現のインプリント遺伝子のB6とPWKの多型によるなどが考えられる。さて、これらの遺伝子の発現減少が肥満に関係するかであるが、Peg3はノックアウトすると体脂肪量が増加することが報告されている(Curley et al., 2005)。Igf2はIGFシグナルを制御する遺伝子であり、その発現の減少が脂肪量の増加と関係することがマウスで報告されており(Jones et al., 2001)、ヒトで血中のIGF2が少ないと肥満のリスクが増すという報告がある(Sandhu et al., 2003)。またヒトのIGF2の多型と肥満との関連性についてのいくつかの報告がある(O'Dell et al, 1999; Gaunt et al, 2001)。
白色脂肪におけるIgf2の発現低下は慢性炎症をとおして肥満をひきおこしているかもしれない。高脂肪食を食べさせたB6の白色脂肪ではMCP-1の発現が上昇し、Glut4やアディポネクチンの発現は減少している。MCP-1は炎症性のサイトカインであるTNF-αなどの分泌を促し、白色脂肪の機能不全をもたらす(De Taeye et al. 2007)。またアディポネクチンは抗炎症性のサイトカインでありインスリン感受性を亢進し(Ravussin, 2002)、血中濃度の低下は2型糖尿病と密接に関連している(Matsuzawa, 2010)。我々はIgf2がTNF-alphaによるMCP-1の上昇とGlut4とアディポネクチン減少を抑えることを見い出した。このことはIgf2が抗炎症作用により糖代謝を改善していることを示唆する。
結論としてB6マウスの高脂肪食による食事誘導性の肥満と耐糖能異常は父性遺伝し、それはインプリント遺伝子のPeg3とIgf2の発現が白色脂肪で減少することと関係していた。このことはPeg3とIgf2が肥満と糖代謝を改善することを示唆する。また実際に3T3-L1脂肪細胞を使った実験でIgf2は抗炎症作用を持ち、糖代謝を改善していた。
参考文献
- Butler MG (2011) Prader-Willi Syndrome: Obesity due to Genomic Imprinting. Curr Genomics. 12:204-215.
- Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, Faloia E, Wang S, Fortier M, Greenberg AS, Obin MS (2005) Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans. J Lipid Res 46:2347-2355.
- Curley JP, Pinnock SB, Dickson SL, Thresher R, Miyoshi N, Surani MA, Keverne EB. FASEB J (2005) Increased body fat in mice with a targeted mutation of the paternally expressed imprinted gene Peg3. FASEB J 19:1302-1304.
- Gaunt TR, Cooper JA, Miller GJ, Day IN, O'Dell SD (2001) Positive associations between single nucleotide polymorphisms in the IGF2 gene region and body mass index in adult males. Hum Mol Genet 10:1491-1501.
- Jones BK, Levorse J, Tilghman SM (2001) Deletion of a nuclease-sensitive region between the Igf2 and H19 genes leads to Igf2 misregulation and increased adiposity. Hum Mol Genet 10:807-814.
- Matsuzawa Y (2010) Adiponectin: a key player in obesity related disorders. Curr Pharm Des 16:1896-1901.
- O'Dell SD, Bujac SR, Miller GJ, Day IN (1999) Associations of IGF2 ApaI RFLP and INS VNTR class I allele size with obesity. Eur J Hum Genet 7:821-827.
- Ravussin E (2002) Adiponectin enhances insulin action by decreasing ectopic fat deposition. Pharmacogenomics J 2:4-7.
- Sandhu MS, Gibson JM, Heald AH, Dunger DB, Wareham NJ (2003) Low circulating IGF-II concentrations predict weight gain and obesity in humans. Diabetes 52:1403-1408.
- Surwit RS, Kuhn CM, Cochrane C, McCubbin JA, Feinglos MN (1988) Diet-induced type II diabetes in C57BL/6J mice. Diabetes 37:1163-1167.