細胞接着分子による脳毛細血管内皮細胞増殖制御機構
Tweet執筆者情報
執筆者:常木雅之
執筆者所属:Yale University School of Medicine, Department of Pathology
E-mail: masayuki.tsuneki@yale.edu
原著論文:CD44 regulation of endothelial cell proliferation and apoptosis via modulation of CD31 and VE-cadherin expression. The Journal of Biological Chemistry 2014 in press (PMID: 24425872).
更新日:2014年2月1日
概要
CD44欠損マウスの脳毛細血管内皮細胞では、透過性が亢進するなど血管形成不全が起こることが明らかになり、細胞間接着分子の発現抑制がその背景として存在する1。したがって、細胞接着依存性の細胞増殖調節不全が示唆された。われわれは、CD44を含めた細胞接着分子が細胞密度を認知し、Hippo経路によりアポトーシスおよび増殖促進因子を厳密に調節し、細胞集団を維持していることを明らかにした。
緒言
哺乳類の脳における神経新生・可塑性を理解するうえで、細胞外基質を介する神経幹細胞と血管内皮細胞相互作用による微小環境(Neuro-vascular niche)の概念は欠かせない。特に、血管新生は微小環境形成基盤となるために、詳細な分子メカニズムの解明が不可欠である。CD44は細胞外基質構成要素であるヒアルロン酸を認識し、細胞・基質間接着を制御するだけでなく、細胞質内ドメインが転写調節因子として核内機能し、細胞外環境の変化を細胞内に的確に伝令している可能性がある2。CD44欠損マウスが、ほぼ正常な外観で生まれてくることは大変な驚きであるが、炎症などによる間質誘導(微小環境誘導)の際には、透過性など血管新生不全がみとめられた1。CD44血管内皮細胞は、細胞増殖態度および細胞形態が野生型とは大きく異なり、興味深いことに、CD31欠損血管内皮細胞と近似していた。したがって、細胞接着依存性の細胞増殖制御機構の解明に臨んだ。
CD44・CD31:血管内皮細胞増殖への関与
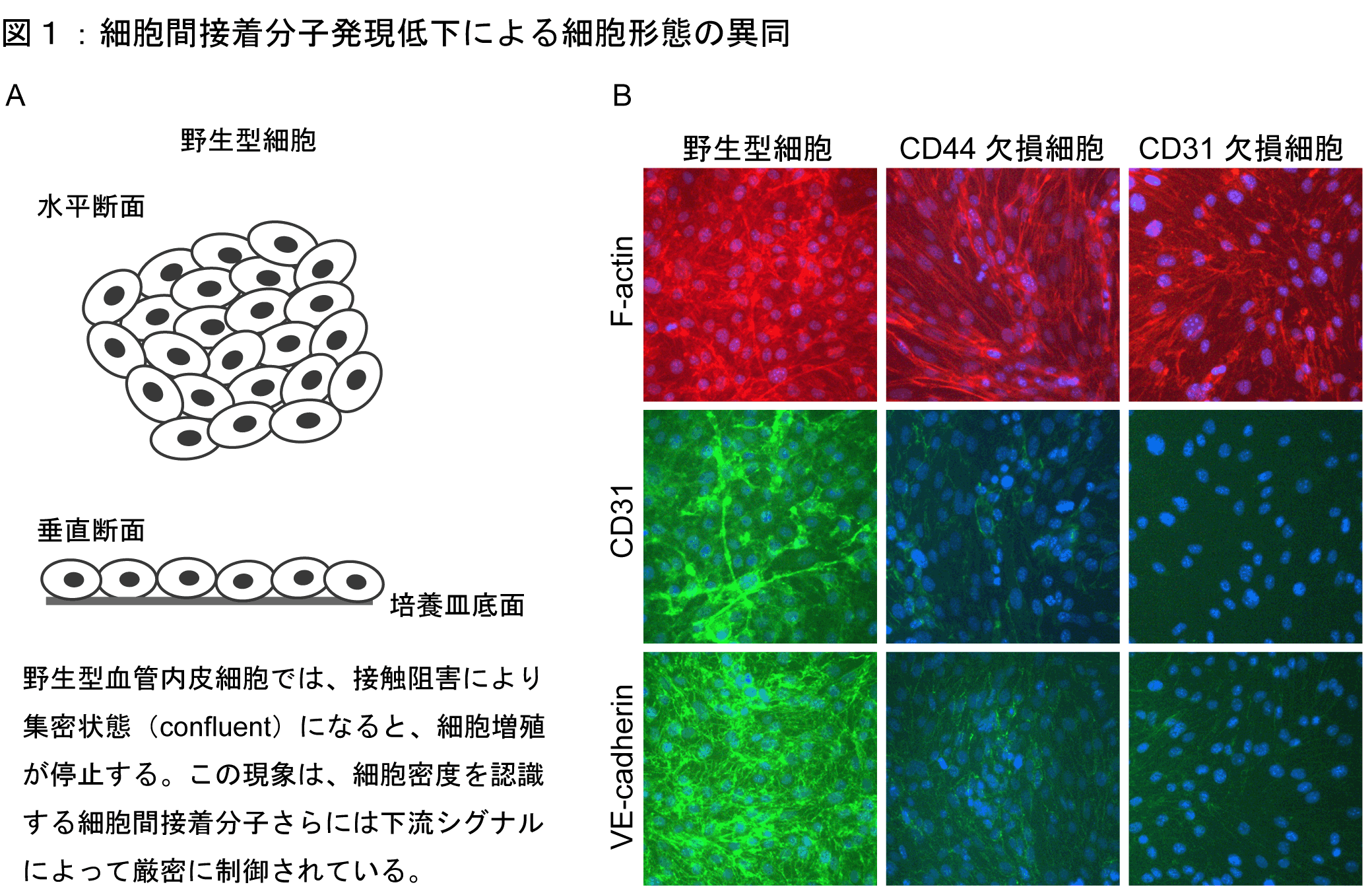
CD44もしくはCD31欠損血管内皮細胞では、細胞が増殖し、集密状態(図1A)以降の増殖率が顕著に増加していた。したがって、接触阻害が起きていないことが考察される。上記分子の欠損株は、野生型に比べて紡錘形であり、線維芽細胞様を呈している(図1B)。CD44欠損では、細胞間接着を司るCD31・VE-cadherinが減弱し、CD31欠損でも同様である(図1B)。興味深いことに、CD44欠損株にCD44またはCD31を再導入した細胞株および、CD31欠損株にCD31を再導入した株では増殖曲線は野生型と有意差がなかった。したがって、細胞間接着分子が細胞形態および細胞密度を規定あるいは認識している可能性がある。
集密培養下でのアポトーシス
CD44欠損血管内皮細胞で、接触阻害が起きず増殖を続ける機構としてカスパーゼを介したアポトーシス3からの回避が予測される。カスパーゼは、initiatorとeffectorに分けられるが3、CD44欠損株では、カスパーゼ8(initiator)とカスパーゼ3(effector)の活性化に顕著な低下がみられた。これは、細胞膜受容体からのシグナルを介したアポトーシス誘導経路の阻害を示唆している。ミトコンドリアや小胞体関連のアポトーシス誘導に差はなかった。CD44欠損株にCD44またはCD31を再導入すると、カスパーゼ8・3の活性化は回復した。以前にわれわれは、カスパーゼ8の活性化がCD31依存性であることを報告しており4、CD31からの直接的なカスパーゼ8活性化機構の解明を進めている。
CD31:細胞外環境を認識しアポトーシスを誘導する
CD31細胞外ドメインを認識する独自の抗体(SL4)を野生型細胞に添加し中和実験を行うと、濃度依存的に細胞形態は紡錘形になり、カスパーゼ8・3の活性化が阻害された。さらに、CD31発現量が異なる複数細胞株でカスパーゼ8・3活性化を比較したところ、CD31発現量とカスパーゼ8・3の活性化は正に相関していた。すなわち集密細胞環境下では、CD31細胞外ドメインが細胞外基質(環境)を認識することで細胞死を調節している可能性が示唆された。
接触阻害:Hippo経路ON
Hippoの名前は、hippopotamus(カバ)に由来している。Hippo経路は、癌抑制遺伝子産物を含めた興味深いシグナル伝達経路で構成されており、隣接細胞からのシグナルをCD44や他の細胞接着分子5から受容し、細胞密度の感知や上皮細胞の極性規定など、広い意味で三次元的組織空間の形成・維持にきわめて重要な役割を果たす5-8。Hippo経路は「形作り(形態形成)」に重要である7,8ために初期発生での機能は欠かすことができないが、Hippo経路調節の破綻(恒常的Hippo-OFF)は制御不能な細胞増殖のトリガーとなり、悪性腫瘍形成機構の理解8,9に重要である。Hippo経路には、重要な構成因子としてYAPがあり、一部は、Ser127がリン酸化している(P-YAP)。Hippo経路がON、すなわち、細胞密度の認知が正常になされているとき(接触阻害が働くとき)は、増殖を負に制御するために、核内および細胞質内のYAPはLats1/2によりリン酸化され(P-YAP)、proteasomeを介する分解系に移行する(図2A)。対して、Hippo経路がOFF、すなわち、細胞密度が十分でないときや、密度認知に破綻をきたしたとき(接触阻害不全)には増殖を正に制御するために、P-YAPの分解処理は抑制され、YAPの核内移行が促進し、転写共役因子として機能する(図2B)。さらに、YAPによって転写促進される抗アポトーシス遺伝子にSurvivinがある10。Survivinはカスパーゼ3活性化を抑制することでアポトーシス抑制に働くために、腫瘍発生における機能に注目が集まっている。さらに、VE-cadherinが血管内皮細胞で抑制されることでSurvivin発現が亢進することが報告されている。
CD44欠損による細胞間接着分子(CD31・VE-cadherin)機能低下、カスパーゼ8・3活性化抑制、Hippo経路OFF?、YAPは?、Survivinは?、ということで役者が揃ったわけである。
CD44およびCD31欠損株ではVE-cadherinの発現量が抑制され、Survivinは亢進した。この抑制および亢進は、CD44またはCD31の再導入系でレスキューされた。さらに、細胞質・核内分画により、YAPおよびP-YAPの両分画での発現量を比較したところ、CD44およびCD31欠損株では、細胞質内分画のP-YAPが減少し、核内分画のYAPが増加した。以上の減少は、タンパク質発現レベルだけでなく、免疫細胞染色により局在を確認し、データを補完した。
まとめ
以上の結果は、細胞間相互作用および細胞外環境認識分子(CD44・CD31・VE-cadherinなど)により細胞周囲の状態(所謂「空気を読む?」)が認識され、細胞密度状況により、Hippo経路のスイッチングが起こり、血管内皮細胞社会が適切にコントロールされていることをあきらかにした(図2)。しかし、いくつかの疑問がある。腫瘍との異同は?、CD44によるCD31発現制御機構の詳細は?、接触阻害を逃れた細胞の結末は?、などである。これらの疑問への詳細な答えを求めて現在、顕微鏡をのぞいている。
本研究に対することなど、なにかございましたらいつでも、メールアドレスまでご連絡ください。
参考文献
1.Flynn, K. M., Michaud, M., Canosa, S., and Madri, J. A. (2013) CD44 regulates vascular endothelial barrier integrity via a PECAM-1 dependent mechanism. Angiogenesis 16, 689-705
2.Seiki, M. (2002) The cell surface: the stage for matrix metalloproteinase regulation of migration. Curr. Opin. Cell Biol. 14, 624-632
3.Riedl, S. J., and Shi, Y. (2004) Molecular mechanisms of caspase regulation during apoptosis. Nat. Rev. Mol. Cell Biol. 5, 897-907
4.Ilan, N., Mohsenin, A., Cheung, L., and Madri, J. A. (2001) PECAM-1 shedding during apoptosis generates a membrane-anchored truncated molecule with unique signaling characteristics. FASEB J. 15, 362-372
5.Badouel, C., and McNeill, H. (2011) SnapShot: The hippo signaling pathway. Cell 145, 484-484 e481
6.Zhao, B., Wei, X., Li, W., Udan, R. S., Yang, Q., Kim, J., Xie, J., Ikenoue, T., Yu, J., Li, L., Zheng, P., Ye, K., Chinnaiyan, A., Halder, G., Lai, Z. C., and Guan, K. L. (2007) Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21, 2747-2761
7.Halder, G., and Johnson, R. L. (2011) Hippo signaling: growth control and beyond. Development 138, 9-22
8.Bao, Y., Hata, Y., Ikeda, M., and Withanage, K. (2011) Mammalian Hippo pathway: from development to cancer and beyond. J. Biochem. 149, 361-379
9.Xu, Y., Stamenkovic, I., and Yu, Q. (2010) CD44 attenuates activation of the hippo signaling pathway and is a prime therapeutic target for glioblastoma. Cancer Res. 70, 2455-2464
10.Hong, W., and Guan, K. L. (2012) The YAP and TAZ transcription co-activators: key downstream effectors of the mammalian Hippo pathway. Semin. Cell Dev. Biol. 23, 785-793
謝辞
一連の研究を遂行するにあたり、絶え間なく、そして本当に心暖かいご指導をいただき、さらには本原稿作成を快諾してくださったイェール大学医学部病理学分野のJoseph Madri教授に心から感謝いたします。また、ラボメートであり、データやサイエンスについて語り合った良き友人であるKelly Flynn博士に感謝します。本研究は、日本学術振興会特別研究員(DC2)奨励費および上原記念生命科学財団海外留学助成金のご支援をいただいたことに感謝いたします。