リソゾームにおけるAKT新規結合因子Phafin2によるオートファジー制御の分子機構の解明
Tweet執筆者情報
執筆者:野口昌幸
執筆者所属:北海道大学 遺伝子病制御研究所 癌生物分野 教授
原著論文:Lysosomal Interaction of Akt with Phafin2: A Critical Step in the Induction of Autophagy. PLoS ONE 9:e79795, 2014.
更新日:2014年2月7日
概要
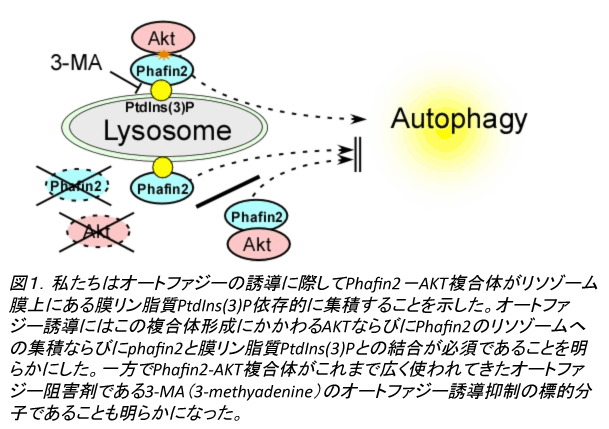
セリンスレオニンキナーゼAKTはオートファジーの制御への関与が推測されているが、 その制御の詳細は不明であった。私たちはAKT新規結合因子としてリソゾーム蛋白Phafin2を同定した。各種オートファジーの誘導に際してPhafin2−AKT複合体がリソゾーム膜上にある膜リン脂質PtdIns(3)P依存的に集積する。オートファジー誘導にはAKTならびにPhafin2のリソゾームへの集積が必須である。
はじめに
哺乳動物細胞のセリンスレオニンキナーゼAKT(Protein Kinase B)は、細胞内における細胞死(アポトーシス)や細胞生存制御において極めて重要な働きをする細胞内シグナル伝達因子である。AKTシグナル伝達系は膜リン脂質のリン酸化を介して活性化され細胞死(アポトーシス)制御の要の分子として、細胞死、細胞増殖、細胞周期、蛋白合成、血管新生、糖代謝など多彩な細胞反応を制御しており、その制御機構の破綻は様々なヒトの疾病の原因となることが知られている。AKTは細胞外からの刺激によりclass I PI3Kによる産物である膜リン脂質PI(3,4,5)P3依存的に細胞膜へ移行し、AKTのPHドメインにこの膜リン脂質[PI(3,4,5)P3]が結合し、PDK1 (Phosphoinositide Dependent Kinase1)の働きによりスレオニン308残基が活性化され、 mTORC2複合体によってセリン473残基が活性化される。活性化されたAKTはFKHR、BAD、GSK3など様々な細胞内基質をリン酸化し、細胞死や細胞増殖を制御することが知られている[1,2]。
一方で生体細胞における生理機能の恒常性は細胞の構成成分であるタンパク質の合成と分解のバランスによって保たれていると考えられる。この細胞内における主たるタンパク質分解系は、ユビキチン・プロテアソーム系に代表される選択的タンパク質分解と、オートファジー・リソソーム系タンパク分解系に代表される非選択的分解とに大別される。
オートファジーは細胞が持っている、自食(じしょく)とも呼ばれる細胞内のタンパク質を分解するための仕組みの一つと考えられ、広義にはリソソームにおける細胞質成分の分解の総称である。近年、哺乳動物におけるオートファジーに関与する遺伝子群(Atgs)が次々と同定され、哺乳動物におけるオートファジーのもつ生理的な意義ならびに分子レベルでの制御機構が明らかになってきた[3]。特に、in vivoにおける解析により哺乳動物におけるオートファジーのもつ生理的さらには感染症、悪性腫瘍をはじめ様々なヒト疾病の背景因子としての役割が注目されている。
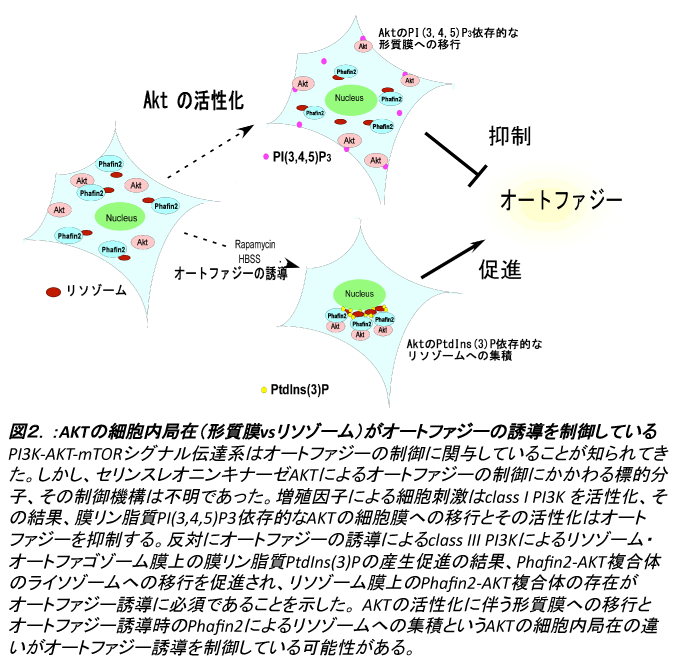
これまで、リソソームを介したオートファジーにはAKTシグナルが関与していることが推測されてきた[4,5]。増殖因子の刺激は細胞内のclass I PI3K 活性化を促し、その代謝産物である膜リン脂質PI(3,4,5)P3依存的なAKTの細胞膜への移行はオートファジーを抑制することが知られてきた。しかし、酵母にはその実質的なorthologの存在しない AKTシグナルによる直接的なオートファジーの制御の標的分子、さらにはその分子レベルでの制御機構の詳細は不明であった。
研究成果
私たちはこれまでにAKTに結合AKT因子による細胞反応の制御の分子機構の解明に向けた研究を進めてきた[6,7]。この方向性での研究を通して私たちは、yeast two hybrid 法ならびに免疫共沈法を用いてライソゾーム(lysosome)に局在するAKTに結合する新しい細胞内分子(Phafin2)を同定した。Phafin2はリソソームに存在する細胞内小器官の輸送などにかかわることが推測されたpleckstrin homology (PH)domain ならびにFYVE (Fab1-YotB-Vac1p-EEA1)domainからなる25KDの小さい分子である。我々はこのPhafin2 がPI3K-AKT-mTORシグナルによりオートファジーへの方向性決定の鍵を握る分子として注目し、その解析を進めた。Phafin2は活性化ならびに非活性化AKTともに結合することが確認できた。蛍光色素を用いた共焦点顕微鏡、sucrose-gradient 法によるリソゾームの精製、分子イメージング(FRET、BiFC)法によりPhafin2‐AKT複合体のリソゾームへの局在とその集積がHBSSやRapamycinによるオートファジーの誘導により増強されることを示した。Phafin2はオートファジー誘導により細胞質に存在するAKTと結合し、Phafin2-AKT複合体としてリソゾーム膜上の膜リン脂質PtdIns(3)P依存的にリソゾームに移行する、このプロセスがオートファジーの誘導には極めて重要で必須であることが明らかとなった。オートファジー誘導にはPhafin2とリソゾーム膜状にある膜リン脂質PtdIns(3)Pとの結合が必須であること、さらにオートファジー誘導ならびにその機能にはAKTならびにPhafin2の存在が必須であることを明らかにした[8]。
考察
本研究ではAKTの新規結合因子としてPH domain, FYVE domainの二つの膜リン脂質PI(3)P結合ドメインを持つリソゾームタンパクPhafin2を同定した。オートファジーの誘導によりAKTがリソゾームに存在する膜リン脂質PtdIns(3)P依存的にPhafin2によりリソゾームに集積することが明らかとなった。このPhafin2-AKT複合体の膜リン脂質PtdIns(3)P依存的なリソゾームへの移行、集積がオートファジー誘導に必須なprocessであることが明らかになった。今回の研究成果によりPhafin2‐AKT複合体はこれまで広く用いられてきたオートファジー阻害剤である3-MA(3-methyadenine)[9]のオートファジー誘導抑制にかかわる分子標的を初めて明らかにすることができた。これまでAKTの活性化はオートファジー誘導を抑制的に作用することが知られてきた[5]。しかし、今回の研究によりAKTの存在自体、とくにAKTの細胞内での分布そのものがオートファジーの誘導の決定に極めて重要なことが明らかとなった。オートファジーの誘導によりPhafin2とともに移行、リソゾームに集積したAKTがどのような働きをしているのかは今後の研究による解明が待たれる。オートファジーの制御の乱れによるタンパク質分解系の異常は、精神神経疾患や悪性腫瘍、感染症など様々なヒトの疾患を引き起こすことが知られている。しかるに一連の研究は、細胞内PI3K- AKT-mTORシグナル伝達によるオートファジー制御の仕組みが明らかにするばかりでなく、Phafin2- AKT複合体を介したオートファジーを制御することで発がん、ウイルス感染、Alzheimer病などにおける病態や細胞反応の制御の開発に向けた道標となる可能性がある。
参考文献
1. Noguchi M, Obata T, Suizu F (2008) Regulation of the PI3K-Akt Network: Current Status and a Promise for the Treatment of Human Diseases. Curr Sig Thera.
2. Noguchi M, Ropars V, Roumestand C, Suizu F (2007) Proto-oncogene TCL1: more than just a coactivator for Akt. FASEB J 21: 2273-2284.
3. Mizushima N, Levine B, Cuervo AM, Klionsky DJ (2008) Autophagy fights disease through cellular self-digestion. Nature 451: 1069-1075.
4. Lum JJ, DeBerardinis RJ, Thompson CB (2005) Autophagy in metazoans: cell survival in the land of plenty. Nat Rev Mol Cell Biol 6: 439-448.
5. Arico S, Petiot A, Bauvy C, Dubbelhuis PF, Meijer AJ, et al. (2001) The tumor suppressor PTEN positively regulates macroautophagy by inhibiting the phosphatidylinositol 3-kinase/protein kinase B pathway. Journal of Biological Chemistry 276: 35243-35246.
6. Laine J, Kunstle G, Obata T, Sha M, Noguchi M (2000) The protooncogene TCL1 is an Akt kinase coactivator. Mol Cell 6: 395-407.
7. Suizu F, Hiramuki Y, Okumura F, Matsuda M, Okumura AJ, et al. (2009) The E3 ligase TTC3 facilitates ubiquitination and degradation of phosphorylated Akt. Dev Cell 17: 800-810.
8. Matsuda-Lennikov M, Suizu F, Hirata N, Hashimoto M, Kimura K, et al. (2014) Lysosomal interaction of akt with phafin2: a critical step in the induction of autophagy. PLoS One 9: e79795.
9. Seglen PO, Gordon PB (1982) 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proceedings of the National Academy of Sciences of the United States of America 79: 1889-1892.