ナイーブ様変換はiPS細胞の能力を向上させる
Tweet執筆者情報
執筆者:本多新
執筆者所属:宮崎大学テニュアトラック推進機構(医学系 発生・生物学分野)
原著論文:Naive-like Conversion Overcomes the Limited Differentiation Capacity of Induced Pluripotent Stem Cells. (The Journal of Biological Chemistry. 288:26157-26166, 2013)
更新日:2014年3月21日
概要
ヒトから樹立されるiPS細胞はいわゆる「プライム型」であり、マウスから樹立される「ナイーブ型」に比べて幹細胞としての分化能に制限があることが知られている。我々は、プライム型として生じるウサギiPS細胞をナイーブ型様に変換することに成功した。その結果、キメラとして胚に寄与できるようになるだけでなく、体外での分化誘導能力も向上した。この技術でヒトiPS細胞をナイーブ型に変換することができれば、分化誘導が困難な細胞や組織を作り出すような展開も期待できる。
はじめに
私たち全ての細胞や組織に分化する能力をもつ胚性幹(ES)細胞は、発生学的な研究で多くの貢献を果たしただけでなく、再生医療のモデルとしての可能性も秘めており、様々な動物種から樹立・解析されてきた。しかしながら、(ヒト)ES細胞は、生命の萌芽でもある胚を滅失して樹立する必要があるために、越えなければならない倫理的問題が大きいとされている。また、再生医療を実現させるためには、移植時に生じる免疫拒絶も克服しなければならない。こうした中、京都大学の山中伸弥博士らの研究グループにより、2006年にマウス由来人工多能性幹(iPS)細胞が、2007年にヒト由来iPS 細胞が、それぞれ樹立された[1 2]。ES/iPS細胞などの多能性幹細胞には、マウスやラットから樹立されるナイーブ型とヒトやサルから樹立されるプライム型とに分類されることがわかってきた[3]。最も大きな相違として、ナイーブ型はキメラ個体を作り出す能力が高く、特に精子や卵子などの生殖細胞に分化する能力があるため、プライム型よりも質的に優れていることが挙げられる。このような背景のなかで、iPS細胞を用いた再生医療を、モデル動物からヒトへ展開させるために、ヒトと同じくプライム型iPS細胞を効率よく樹立できるような小型で扱いやすい実験動物が求められている。そこで私達はウサギに着目した。ウサギは実験動物として利用されてきた歴史が古く、性格も温和で、マウスに比べてはるかに大型であるため、薬理・免疫・安全性試験などで積極的に利用されてきたが、霊長類やブタのように大型ではないため移植実験も容易であり、飼育コストも抑えることができる。繁殖も容易で受精や胚発生に関しても基礎的知見が充実している。妊娠期間も31日間と短く、多産であることからも、次世代への影響を解析する上で他の家畜動物や霊長類に比べて非常に有利である。さらに、ウサギES細胞はプライム型でヒトに近いことが期待できた[4]。つまり、将来ヒトへの橋渡しとなる研究を幹細胞で発展させるうえで非常に便益な実験動物であった。
ウサギiPS細胞の樹立
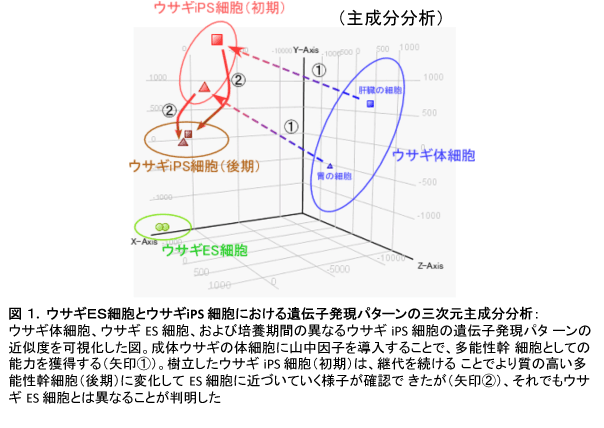
我々は以前、ウサギ成体の胃と肝臓由来の細胞から比較的高効率でiPS細胞を樹立することに成功している[5]。作製したiPS細胞の解析を行ったところ、ウサギiPS 細胞は予想どおりプライム型を示すことが明らかとなった。また、継代を繰り返すことで外来遺伝子の発現が抑制され、継代数20以下でほぼ完全に外来遺伝子の発現が押さえられていることも明らかとなった。さらに、作製したウサギiPS 細胞とウサギES 細胞の網羅的な遺伝子発現を解析するために、DNAマイクロアレイ解析を行った。iPS細胞のドナー細胞(胃・肝臓)、継代数の異なるウサギiPS細胞(樹立初期・樹立後期)とウサギES 細胞について、それぞれの遺伝子発現パターンを比較した。その結果、肝臓と胃の細胞に山中因子を導入すると、多能性幹細胞としての特徴を獲得するが、継代を繰り返すことで、外来遺伝子の発現が抑制され、ES細胞に近づいていくことが判明した(図1)。しかしながら、そのようなiPS細胞でも約220個の遺伝子発現に相違が認められ、ES細胞とは明らかに異なる多能性幹細胞であることが明らかとなった。
体外分化効率を指標としたiPS細胞の質的改善
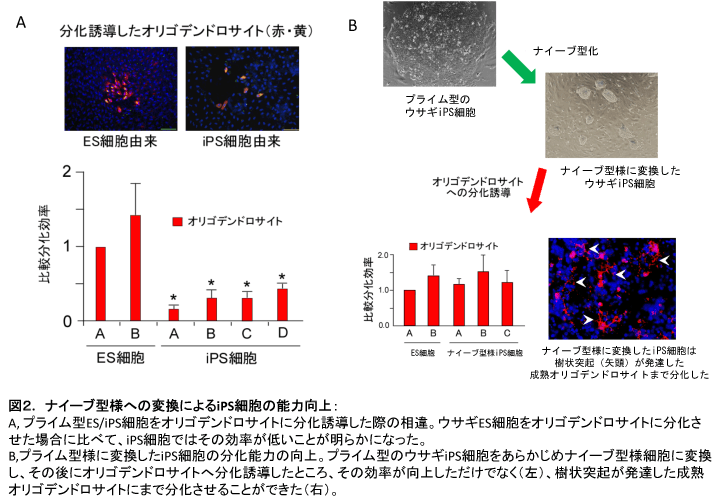
ウサギの胃と肝臓から樹立したiPS 細胞は、プライム型を示すことや、ES細胞の遺伝子発現とは一致しないことが明らかとなった。多能性幹細胞は、目的の細胞や組織に分化誘導した後に、様々な研究に利用されることが多い。そこで、我々が樹立したES細胞とiPS 細胞に見いだされた遺伝子発現の相違が、目的の細胞や組織への分化誘導能としても顕在化するか否かを検討した。そのために、まずウサギES 細胞を用いて試験管内で神経系の細胞(神経幹細胞、神経細胞、及びアストロサイト)に分化誘導するシステムを構築し、続いて、各種iPS細胞とその分化効率を比較した [6]。その結果、iPS 細胞の方がES細胞よりも神経細胞系への分化能が低いことが判明した。さらに、肝臓由来の樹立初期iPS細胞は、胃から樹立したiPS細胞と比較して、神経系の細胞への分化効率が明らかに低かった。つまり、iPS細胞を効率よく分化させるためには、どのようなドナー細胞からiPS細胞を樹立するかを検討する必要があることが示唆された。一方、分化効率の悪い肝臓由来のiPS細胞を一定期間以上培養し、外来山中因子がサイレンシングされた状態にまで安定化させれば、ES 細胞と同様に分化誘導できることも明らかとなった。ところが、より分化誘導が困難な神経系の細胞種であるオリゴデンドロサイトにまで分化誘導を施すと、ドナー細胞差や培養期間の長さに関わらず、iPS細胞の分化効率はES細胞よりはるかに劣ることが明らかとなった。
マウスやラットから樹立されるナイーブ型のiPS細胞はキメラ個体を作り出す能力、および精子や卵子などの生殖細胞に分化する能力が高く、質的にプライム型の幹細胞に比べて優位であることは上述した。そこで私達は、プライム型を示すウサギiPS細胞をナイーブ型iPS細胞に変換できれば、ウサギiPS細胞の質が向上し、その結果、分化効率が向上するのではないかと考え、ウサギiPS細胞のプライム型からナイーブ型への変換を試みた。先行研究[7]により、Klf4とOct3/4の過剰発現がマウス型に変換するために効果的であることがわかっていたが、培養環境の変換だけではKlf4の発現しか向上させることができず、細胞分裂が停止してしまったため、多能性幹細胞においてサイレンシングのかかりにくいEF1αプロモーター制御でOct3/4を導入し、過剰発現させることでナイーブ型への変換を試みた。その結果、ナイーブ型iPS細胞の形態的特徴であるドーム型のコロニーが生じ、その状態をFibroblast Growth Factor 2:FGF2非存在下で50代以上継代・維持できるようになった。
このように改変したウサギiPS細胞は、胚盤胞の内部細胞塊には寄与するが、キメラ産仔として寄与するまでには至らなかったことから、私達はこの細胞をナイーブ型“様”iPS細胞と呼んでいる。この細胞を、オリゴデンドロサイトに分化誘導し、ES細胞とマウス型様iPS細胞で分化効率を比較した。すると予想通り、プライム型のウサギiPS細胞と比較して、ナイーブ型様に変換したiPS細胞では、オリゴデンドロサイトへの分化効率が試した全てのラインで向上した。さらに、ES細胞からでさえも分化誘導が困難であった、樹状突起の発達した成熟オリゴデンドロサイトにまで分化させることにも成功した(図2)。これらの結果より、ES細胞に比べて、分化能の低いiPS 細胞であっても、ナイーブ型様に変換することで、分化効率をES細胞と同等、あるいはそれ以上に向上させられることが明らかとなった[6]。より質の高いiPS 細胞を作り出す技術改良は、今後のiPS 細胞が様々な分野で有効に利用されるためにも必要不可欠であると考えられる[8 9]。
おわりに
iPS細胞をヒトの医療へ利用するには、実験動物による解析が必要不可欠であろう。現在様々な動物種からの樹立が報告されているが、その再現性や樹立したiPS細胞の質的な評価には課題が残っている。ウサギは実験動物学的にも幹細胞学的にもヒトのモデルを構築する上で非常に優れた利点を兼ね備えている。ウサギであれば、数多くの試行錯誤を検討することが比較的に容易であるため、そこで得られた知見や技術を、サルなどの動物で確認するような研究展開であれば、効率よくヒトへの橋渡し研究を発展させることができる。各動物種の利点を最大限に有効活用し、動物種普遍の原理や動物種特異的な現象を理解しながら、ヒトへの展開を目指すことが、より安全で確実な医療への応用に役立つはずである。
参考文献
1. Takahashi K and Yamanaka S. (2006) Cell 126:663-676.
2. Takahashi K et al. (2007) Cell 131:861-872.
3. Nichols J and Smith A. (2009) Cell Stem Cell 4:487-492.
4. Honda A et al. (2009) Experimental Cell Research 315:2033-2042.
5. Honda A et al. (2010) The Journal of Biological Chemistry 285:31362-31369.
6. Honda A et al. (2013) The Journal of Biological Chemistry 288:26157-26166.
7. Hanna J et al. (2010) PNAS 107:9222-9227.
8. Fujishiro SH et al. (2013) Stem Cells and Development 22:473-482.
9. Gafni O et al. (2013) Nature 504:282-286.