崪擏庮偑傫姴嵶朎暘夋偵偍偗傞microRNA-133a偺椪彴揑堄媊側傜傃偵帯椕揑堄媊
Tweet幏昅幰忣曬
幏昅幰丗摗尨抭梞丄愳堜復丄旜頃晀暥丄棊扟岶峀
幏昅幰強懏丗崙棫偑傫尋媶僙儞僞乕尋媶強暘巕嵶朎帯椕尋媶暘栰丄崙棫偑傫尋媶僙儞僞乕拞墰昦堾崪擃晹庮釃丒儕僴價儕僥乕僔儑儞壢丄壀嶳戝妛戝妛堾堛帟栻妛憤崌尋媶壢惍宍奜壢妛嫵幒
尨挊榑暥丗Clinical Relevance and Therapeutic Significance of microRNA-133a Expression Profiles and Functions in Malignant Osteosarcoma-Initiating Cells. (Stem Cells 32:959-973, 2014)
峏怴擔丗2014擭4寧26擔
奣梫
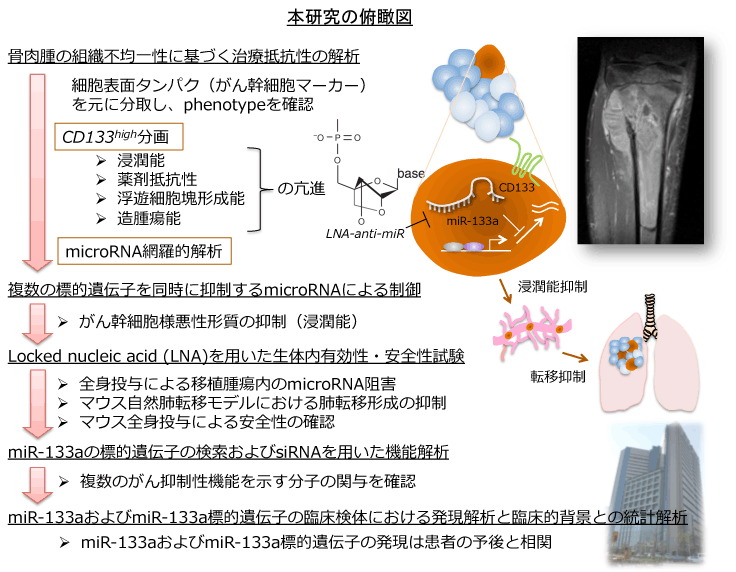
杮尋媶偱偼丄崪擏庮慻怐撪偺CD133high暘夋偑偑傫姴嵶朎條宍幙傪帵偟丄miR-133a偑偦偺宍幙傪惂屼偟摼傞偙偲傪尒弌偟偨丅locked nucleic acid (LNA)傪梡偄偨miR-133a偺婡擻慾奞偵傛傝丄摦暔惗懱撪偵偍偄偰庮釃恑揥梷惂岠壥傪摼偨丅偝傜偵丄椪彴専懱慻怐偵偍偗傞miR-133a偍傛傃偦偺昗揑暘巕偺敪尰偑崪擏庮姵幰偺梊屻偲枾愙偵憡娭偟偰偄傞偙偲偑柧傜偐偵側偭偨丅
弿尵
晄嬒堦側嵶朎廤抍偱偁傞娻慻怐偺拞偵姴嵶朎條偺嵶朎偑娷傑傟傞偙偲偑條乆側埆惈庮釃偱柧傜偐偵偝傟偰偄傞 [1,2]丅偄傢備傞偑傫姴嵶朎乮Tumor-initiating cells; TICs乯偲屇偽傟傞偙偺嵶朎廤抍偼丄栻嵻懴惈擻傗怹弫丒揮堏擻傕桳偟偰偄傞偙偲偑柧傜偐偵偝傟偰偄傞[3,4]丅偑傫帯椕偵偍偄偰丄栻嵻懴惈擻傗怹弫丒揮堏擻偼崕暈偡傋偒壽戣偱偁傝丄偦偺堄枴偱傕偑傫姴嵶朎偺惈忬夝愅偲偦傟傪昗揑偲偟偨怴婯帯椕朄偺峔抸偼旕忢偵廳梫側壽戣偱偁傞丅擏庮偼嬌傔偰慻怐妛揑晄嬒堦惈偑嫮偄庮釃偺1偮偱偁傞[5,6]丅偙傟傑偱偵擏庮偵偍偗傞偑傫姴嵶朎偺懚嵼傪帵嵈偡傞曬崘傕嶶尒偝傟傞偑[7,8]丄偦偺暘巕婡峔側傜傃偵惂屼曽朄偼枹偩夝柧偝傟偰偄側偄丅変乆偼崪擏庮偵偍偗傞偑傫姴嵶朎條宍幙傪妋擣偡傞偲嫟偵丄偦偺暘巕婡峔偺夝愅側傜傃偵暋悢偺惈幙傪摨帪偵惂屼偟摼傞microRNA乮miRNA乯傪婎斦偲偟偨妀巁惢嵻偺壜擻惈傪専摙偟偨丅傑偨丄椪彴専懱偍傛傃椪彴僨乕僞傪夝愅偟丄偙偺傛偆側埆惈宍幙傪巌傞暘巕傪帯椕昗揑偲偡傞椪彴揑堄媊傪専摙偟偨丅
崪擏庮CD133high暘夋偑帵偡埆惈宍幙偲miR-133a偵傛傞惂屼
崪擏庮偺暋悢偺嵶朎姅側傜傃偵姵幰惗専専懱偵偍偄偰CD133high暘夋偼10%埲壓偺妱崌偱懚嵼偡傞偙偲偑敾柧偟偨丅偙偺暘夋偼帺屓暋惢擻椡偲暘壔擻傪摨帪偵桳偟丄晜梀嵶朎夠宍惉擻椡傪帩偮偲偲傕偵栻嵻掞峈惈媦傃傛傝嫮偄怹弫擻傪帵偟偨丅傑偨丄杮暘夋偵偍偄偰帺屓暋惢丄栻嵻攔弌億儞僾偍傛傃揮堏偵娭梌偡傞儅乕僇乕偼敪尰槾恑傪帵偟丄摦暔惗懱撪偵偍偄偰傕尠挊側憿庮釃惈傪帵偡偙偲偑敾柧偟偨丅CD133high暘夋偍傛傃CD133low暘夋偵偍偗傞miRNA偺microarray夝愅傪峴偭偨偲偙傠丄慜幰偵偍偄偰miR-133a偺敪尰槾恑偑帵偝傟偨丅miR-133a暘巕偺嵶朎撪摫擖偵傛傝丄CD133low暘夋偺怹弫擻偑槾恑偟丄媡偵locked nucleic acid(LNA)傪梡偄偨婡擻夝愅偵傛傝丄CD133high暘夋偺怹弫擻偑梷惂偝傟傞偙偲偑敾柧偟偨丅
壔妛椕朄偵傛傞miR-133a偺敪尰桿摫
崪擏庮帯椕偵梡偄傜傟傞僪僉僜儖價僔儞(DOX)丄僔僗僾儔僠儞(CDDP) 偺朶業偵傛傝丄僸僩崪擏庮崅揮堏嵶朎姅偵偍偄偰miR-133a偺敪尰偑槾恑偡傞偙偲偑敾柧偟偨丅miR-133a偺嵶朎撪摫擖偵傛傝崪擏庮嵶朎偺怹弫擻偑槾恑偡傞偙偲偐傜丄壔妛椕朄偵嵺偟偰杮暘巕傪婡擻慾奞偡傞偙偲偑帯椕掞峈惈桿摫偺梷惂偵廳梫偱偁傞偲峫偊傜傟偨丅
扴娻摦暔偵懳偡傞LNA-antmiR-133a慡恎搳梌偺岠壥
LNA-antimiR-133a偺惗懱撪岠壥傪崪擏庮帺慠攛揮堏儌僨儖傪梡偄偰夝愅偟偨丅儖僔僼僃儔乕僛敪尰僸僩崪擏庮崅揮堏姅傪僰乕僪儅僂僗偺泺崪撪偵堏怉偟丄乮i乯惗怘/惗怘孮丄乮ii乯LNA-NC乮僐儞僩儘乕儖LNA乯/惗怘孮丄乮iii乯LNA-antimiR-133a/惗怘孮丄乮iv乯LNA-NC/CDDP孮丄乮v乯LNA-antimiR-133a /CDDP孮偺5孮偵暘偗偰昡壙偟偨丅庮釃撪偺miR-133a敪尰梷惂偵偼drug delivery system傪昁梫偲偣偢丄LNA-antimiR-133a旜惷拲偺傒偱廫暘側岠壥偑妋擣偝傟偨丅帯椕幚尡偺寢壥丄LNA-antimiR-133a暪梡偺桳柍偵傛傞庮釃僒僀僘偺曄壔偼傒傜傟側偐偭偨偑丄LNA-antimiR-133a偲僔僗僾儔僠儞偺暪梡孮偵偍偄偰攛揮堏宍惉偼嵟傕嫮偔梷惂偝傟偨丅miR-133a偺攝楍偼僸僩偍傛傃儅僂僗偺庬娫偱曐懚偝傟偰偍偄傞偑丄宱夁娤嶡拞偵柧傜偐側撆惈偼傒傜傟側偐偭偨丅
miR-133a偺昗揑堚揱巕偺摨掕
Ago-2暋崌懱偵懳偡傞柶塽捑崀側傜傃偵miR-133a摫擖偵傛傞mRNA偺曄壔偺microarray夝愅偐傜miR-133a偺昗揑暘巕傪摨掕偟偨寢壥丄偑傫梷惂惈婡擻傪桳偡傞暋悢偺昗揑堚揱巕偑摨掕偝傟偨丅偦傟偧傟偺siRNA傪梡偄偨婡擻夝愅偐傜丄SGMS2, UBA2, SNX30, ANXA2偑怹弫擻惂屼偵娭梌偟偰偄傞偙偲偑敾柧偟偨丅偙傟傜偺暘巕偺3乫UTR assay偵傛傝丄昗揑堚揱巕偺敪尰偑棟榑忋偺寢崌晹埵傪夘偟偰miR-133a偵傛偭偰惂屼偝傟偰偄傞偙偲傪妋擣偟偨丅傑偨丄愭峴偺摦暔帯椕儌僨儖偵偍偗傞LNA-antimiR-133a搳梌孮偺庮釃撪偵偍偄偰昗揑暘巕偑槾恑偟偰偄傞偙偲傪妋擣偟偨丅
miR-133a偍傛傃偦偺昗揑堚揱巕偺敪尰偲崪擏庮姵幰偺椪彴揑攚宨偲偺憡娭惈
崪擏庮椪彴専懱偵偍偗傞miR-133a偺敪尰傪怴慛愗彍惗専慻怐傪梡偄偰夝愅偟偨寢壥丄CD133high暘夋偵偍偗傞miR-133a偼槾恑偟偰偄傞偙偲偑敾柧偟丄嵶朎姅傛傝摼傜傟偨寢壥偲偺惍崌惈傪摼偨丅偝傜偵丄崙棫偑傫尋媶僙儞僞乕拞墰昦堾偱摼傜傟偨惗専専懱48椺傪懳徾偵miR-133a偍傛傃偦偺昗揑堚揱巕偺敪尰偲椪彴僨乕僞傪夝愅偟偨偲偙傠丄庮釃撪miR-133a偺敪尰崅抣偍傛傃昗揑堚揱巕偺敪尰掅抣偑姵幰梊屻晄椙偲桳堄偵憡娭偟偰偄傞偙偲偑尒弌偝傟丄杮暘巕傪帯椕昗揑偲偡傞堄媊偑帵偝傟偨丅
峫嶡
偑傫帯椕偼崱丄偑傫慻怐偵愽傓帯椕掞峈惈偺崅偄丄偁傞偄偼丄帯椕掞峈惈傪妉摼偟偨嵶朎廤抍偵偳偆懳張偟偰偄偔偐偲偄偆怴偨側壽戣偵捈柺偟偰偄傞丅乽偑傫姴嵶朎棟榑乿偼枹偩偦偺慡杄偼柧傜偐偵側偭偰偄側偄偑丄偙偺傛偆側偑傫慻怐撪偺婡擻揑晄嬒堦惈偵拝栚偟偨條乆側偑傫庬偺帯椕奐敪偵婑梌偟偰偄傞丅変乆偼崪擏庮慻怐撪偺傛傝嫮偄埆惈宍幙傪帵偡嵶朎廤抍傪摨掕偟丄尰峴帯椕朄偵妀巁惢嵻傪壛偊偨怴偟偄慜椪彴帋尡傪峴偄丄埲壓偺4偮偺帠崁傪尒弌偟偨丅戞堦偵丄崪擏庮CD133high暘夋偵偼偑傫姴嵶朎條惈幙傪帵偡嵶朎偑enrich偝傟偰偄傞偙偲傪尒弌偟偨丅偙偺暘夋偼晜梀嵶朎夠宍惉擻丄怹弫擻丄憿庮釃擻偲偄偭偨偄傢備傞偑傫姴嵶朎條宍幙傪帵偟偨丅偙偺暘夋傪慱偄寕偮偙偲偑廳梫偲峫偊傜傟傞偑丄CD133偼惓忢崪悜嵶朎側偳偵傕敪尰偑傒傜傟傞偙偲偐傜昗揑偲偡傞偵偼埨慡惈偑婋湝偝傟傞丅廬偭偰偙偺暘夋偺惈幙偍傛傃暘巕婡峔傪夝愅偟丄摫偒弌偝傟偨pathway偺惂屼傪夘偟偰埆惈宍幙傪梷惂偡傞偙偲偑廳梫偲峫偊傜傟偨丅戞擇偵丄miR-133a偑CD133high暘夋偺惈幙偵娭梌偡傞偙偲傪摿掕偟偨丅miR-133a偺昗揑堚揱巕偲偟偰摿掕偝傟偨暋悢偺昗揑堚揱巕偺堦晹偼偑傫梷惂惈偺婡擻傪帵偡偙偲偑曬崘偝傟偰偍傝丄崪擏庮偵偍偗傞怴偨側婡擻暘巕偺峏側傞夝愅偑朷傑傟傞丅戞嶰偵丄LNA偼傾儞僠僙儞僗宆miRNA慾奞嵻偲偟偰屌宍偑傫帯椕偵桳岠惈傪帵偡偙偲偑敾柧偟偨丅LNA偼儕儃妀巁偺屲扽摐偺2乫埵偲4乫埵偲偑儊僠儗儞壦嫶乮O-CH2-壦嫶乯偝傟丄僐儞僼僅儊乕僔儑儞傪N宆偲側傞傛偆偵壔妛廋忺偡傞偙偲偵傛傝懳徾妀巁暘巕偲偺僴僀僽儕僟僀僛乕僔儑儞偑嫮壔偝傟偰偄傞丅婛偵枬惈C宆娞墛偵懳偡傞帯椕栻偲偟偰椪彴帯尡偺抜奒偵擖偭偰偍傝丄怴婯妀巁堛栻偲偟偰拲栚偝傟偰偄傞[9,10]丅偙傟傑偱偵屌宍偑傫偵懳偡傞桳岠惈帋尡偺曬崘偼朢偟偔丄崪擏庮帯椕偵偍偗傞桳岠惈偑婜懸偝傟傞丅戞巐偵丄崪擏庮偑傫姴嵶朎條惈幙傪惂屼偡傞miR-133a偍傛傃偦偺昗揑堚揱巕偼崪擏庮偵偍偗傞怴偨側梊屻場巕偱偁傞偙偲偑敾柧偟偨丅嬤擭丄僸僩埆惈庮釃偵偍偗傞偑傫姴嵶朎儅乕僇乕敪尰棪偲姵幰偺梊屻偲偺娫偵晧偺憡娭偑偁傞偙偲偑曬崘偝傟偮偮偁傞丅杮尋媶偵傛傝丄擏庮偵偍偄偰傕偑傫姴嵶朎條惈幙娭楢暘巕偵懳偡傞帯椕揑堄媊偑帵偝傟傞偙偲偲側偭偨丅
杮尋媶偵傛傝丄崪擏庮偺慻怐晄嬒堦惈偲帯椕掞峈惈偲偺娭楢偑柧傜偐偲側傝丄暋悢偺昗揑堚揱巕傪帩偮miRNA偺婡擻慾奞偵傛傝埆惈宍幙傪惂屼偱偒傞壜擻惈偑帵偝傟偨丅偝傜偵椪彴専懱偺夝愅偵傛傝miR-133a婡擻慾奞偺帯椕揑堄媊傕帵偝傟偨丅LNA偼怴婯妀巁惢嵻偲偟偰偦偺壜擻惈偑拲栚偝傟偰偍傝丄擏庮帯椕偵偍偄偰傕偦偺岠壥偑婜懸偝傟傞
嶲峫暥專
1. Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111.
2. Clarke MF, Dick JE, Dirks PB, et al. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells. Cancer research. 2006;66:9339-9344.
3. Clevers H. The cancer stem cell: premises, promises and challenges. Nature medicine. 2011;17:313-319.
4. Visvader JE, Lindeman GJ. Cancer stem cells in solid tumours: accumulating evidence and unresolved questions. Nature reviews. Cancer. 2008;8:755-768.
5. Aogi K, Woodman A, Urquidi V, et al. Telomerase activity in soft-tissue and bone sarcomas. Clinical cancer research : an official journal of the American Association for Cancer Research. 2000;6:4776-4781.
6. Naka N, Takenaka S, Araki N, et al. Synovial sarcoma is a stem cell malignancy. Stem Cells. 2010;28:1119-1131.
7. Gibbs CP, Kukekov VG, Reith JD, et al. Stem-Like Cells in Bone Sarcomas: Implications for Tumorigenesis. Neoplasia. 2005;7:967-976.
8. Siclari VA, Qin L. Targeting the osteosarcoma cancer stem cell. Journal of orthopaedic surgery and research. 2010;5:78.
9. Lanford RE, Hildebrandt-Eriksen ES, Petri A, et al. Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection. Science. 2010;327:198-201.
10. Kim M, Kasinski AL, Slack FJ. MicroRNA therapeutics in preclinical cancer models. Lancet Oncol. 2011;12:319-321.