NLRP3は好中球遊走能を制御することにより、インフラマソーム非依存的に肝臓虚血再灌流障害形成に寄与する
Tweet執筆者情報
執筆者:井上賢之1,2、高橋将文2
執筆者所属:1自治医科大学 消化器・一般外科学講座、2自治医科大学 分子病態治療研究センター 炎症・免疫研究部
連絡先:〒329-0498 栃木県下野市薬師寺3311-1、masafumi2@jichi.ac.jp
原著論文:NLRP3 regulates neutrophil functions and contributes to hepatic ischemia-reperfusion injury independently of inflammasomes. (The Journal of Immunology 192:4342-4351, 2014)
更新日:2014年6月17日
概要
NLRP3はNod-like receptorに属するパターン認識受容体の一つとして知られており、NLRP3インフラマソームを形成して無菌性炎症に関与することが特に注目を集めている。本研究では、NLRP3がインフラマソームとは独立して肝臓の虚血再灌流障害に寄与し、その分子機構としてNLRP3がG蛋白質共役型受容体を介した好中球遊走能を制御することを明らかにした。
背景
肝臓の虚血再灌流障害は、肝切除・肝移植後肝不全を引き起こす重大な原因である。また、外傷、出血性ショック、敗血症、うっ血性心不全や呼吸不全など肝虚血を起こす原因は多岐にわたる。肝虚血再灌流障害では、炎症反応が関与しており、炎症性サイトカインやケモカインなどの過剰な産生によって好中球を主体とした循環白血球の虚血肝への集蔟が生じ、肝障害が引き起こされる(1)。実際、動物モデルにおいて、好中球除去や中和抗体を用いて好中球の集蔟を阻害することで炎症を抑制すると、肝虚血再灌流障害が劇的に改善されることが示されている(2)。
近年、病原体の関与しない環境で生じる炎症反応として、痛風や動脈硬化などにおける無菌性炎症が注目されており、この無菌性炎症にマクロファージや好中球といった自然免疫系細胞に形成されるインフラマソーム(inflammasome)と呼ばれる分子複合体が重要な役割を担っていることがわかってきた(3) (4)。なかでも、NLRP3インフラマソームが無菌性炎症に関与することが示されており、これはパターン認識受容体の一つであるNod-like receptorに属するNLRP3とアダプター分子ASC、そしてカスパーゼ-1とで構成される。何らかの刺激によりインフラマソームが形成されると、インターロイキン(IL)-1β変換酵素として知られるカスパーゼ-1が活性化し、IL-1β前駆体が切断されて成熟型IL-1βとなり、分泌されて炎症反応が引き起こされる。我々はこれまで、マウス心虚血再灌流モデルを用いて、初期の炎症反応惹起におけるインフラマソームの重要性を報告している(5)。そこで、肝虚血再灌流モデルにおいても、NLRP3インフラマソームが炎症反応惹起と、その後の組織障害に関与しているとの仮説のもとで検討を行った。
肝虚血再灌流障害ではインフラマソーム非依存的にNLRP3が関与している
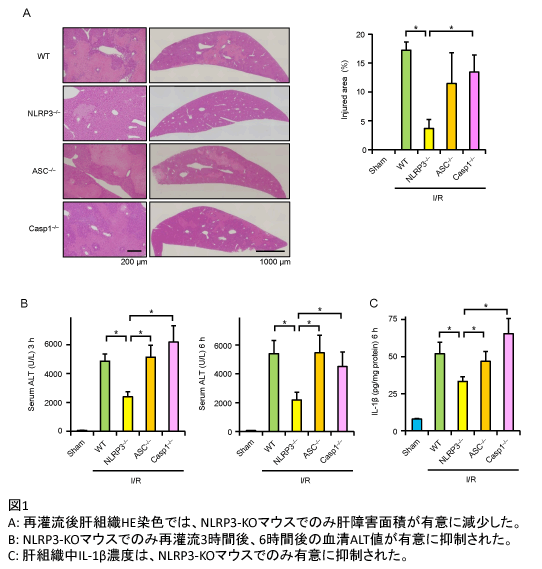
野生型(WT)マウスに70%部分肝虚血再灌流(虚血時間60分)モデルを作成したところ、NLRP3 mRNA発現の有意な増加を認め、NLRP3インフラマソームの関与が示唆された。そこで、WTマウスに加え、NLRP3、ASC、カスパーゼ-1の各欠損(KO)マウスを用いて同モデルを作成して解析した。WTマウスと比較して、NLRP3-KOマウスでは肝障害の程度を示す血清ALT値が有意に抑制されていたが、他のインフラマソーム構成分子であるASC-KOおよびカスパーゼ-1-KOマウスでは、血清ALT値に有意な差を認めなかった(図1B)。次に、再灌流後肝組織をHE染色して肝障害面積を測定したところ、血清ALT値と同様にNLRP3-KOマウスでのみ、WTマウスと比較して有意に抑制されていた(図1A)。インフラマソームはIL-1β産生を制御することから、肝組織中IL-1β濃度も測定したが、NLRP3-KOマウスでは有意な低値を示したが、ASC-KOおよびカスパーゼ-1-KOマウスではIL-1βの産生が抑制されなかった(図1C)。さらに、IL-1β-KOマウスを用いて同モデルを作成したところ、肝障害が劇的に抑制されていた。これらの結果より、肝虚血再灌流障害では、NLRP3がインフラマソームとは独立してその病態に寄与しており、同時にインフラマソーム非依存性のIL-1β産生を介した炎症反応が重要であることが示唆された。
NLRP3欠損により炎症性サイトカインや活性酸素種の産生、アポトーシスの誘導が抑制される
Real-time RT-PCR法を用いて、炎症性サイトカインのmRNA発現を測定したところ、WTマウスと比較して、NLRP3-KOマウスにおいて、IL-1βやIL-6、CCL2の発現が低下していた。また、活性酸素種の産生を4-HNEおよび8-OHdGといった酸化ストレスマーカーの免疫組織化学染色で、アポトーシスをTUNEL染色で評価したところ、WTマウスと比較してNLRP3-KOマウスでは、活性酸素種およびアポトーシスともに減少していた。
NLRP3欠損により虚血再灌流肝への好中球浸潤が抑制される
虚血再灌流後肝への炎症細胞浸潤を検討するため、フローサイトメトリー法を用いて、好中球・マクロファージの評価を行った。再灌流後、WTマウスで増加していた浸潤好中球は、NLRP3欠損マウスで有意に減少していた。一方、浸潤マクロファージに関しては、WTとNLRP3欠損マウスとの間で有意な差を認めなかった。
NLRP3はG蛋白質共役受容体シグナル経路を介して好中球遊走能を制御する
NLRP3-KOマウスでは、好中球浸潤が有意に抑制していたことから、NLRP3-KOマウス由来の好中球がWTマウス由来の好中球と異なった特徴があると推測した。そこで、WTとNLRP3-KOマウスから腹腔内滲出好中球を採取して、初代肝細胞との低酸素下共培養システムを作成し、好中球の有する肝細胞に対する傷害能を検討したが、WTとNLRP3-KO好中球で有意な差を認めなかった。また、好中球は傷害組織から産生されるKC(CXCL1)やMIP-2(CXCL2)といったケモカインによって遊走が誘導されて組織に浸潤していくことから、好中球の持つCXCL1に対する遊走能を検討したところ、WTと比較してNLRP3-KO好中球では遊走能が有意に低下していることが明らかとなった(図2A)。さらに、詳細な分子機序を検討するため、KCの受容体であるG蛋白質共役受容体のCXCR1とCXCR2の細胞表面発現をフローサイトメトリー法で検討したが、有意な差を認めなかった。しかし、好中球膜分画を精製し、KC刺激時の3量体G蛋白質に結合する [35S] GTPγS結合を測定したところ、NLRP3-KO好中球由来の膜分画においてGTPγS結合能が有意に低く、ケモカインを介した細胞遊走のシグナル伝達経路が抑制されていることがわかった(図2B)。さらに、このシグナル経路の下流にあるカルシウムイオンの流入、低分子量G蛋白質Rac1の活性化、アクチン重合といった現象もNLRP3-KOマウス由来の好中球で抑制されていることを確認した(図2C-F)。
考察
虚血再灌流障害において炎症が重要な役割を果たしていることは明らかであるが、肝虚血再灌流において、どのようにしてこの無菌性炎症が惹起されているかはわかっていない。本研究では、無菌性炎症とそれに続く肝障害がインフラマソームを介していると仮説を立てて検討を行った。インフラマソームの定義はカスパーゼ-1を活性化する分子プラットフォームであるが(3)、カスパーゼ-1およびその上流のASCの欠損では肝障害が抑制されず、NLRP3およびIL-1βの欠損により肝障害が抑制されることを見出した。この所見は、NLRP3がインフラマソームとは独立して肝虚血再灌流障害に寄与していることを示唆している。一方、虚血再灌流肝におけるIL-1β濃度の測定では、NLRP3欠損ではIL-1βが抑制されるが、ASCやカスパーゼ-1の欠損では抑制されないことも明らかとなった。つまり、これらの結果から、NLPR3が関与するインフラマソーム非依存性のIL-1β産生機構が重要であることが示唆された。さらに我々は、NLRP3がケモカイン刺激に対する好中球遊走を制御するという、NLRP3のインフラマソームとは独立した新たな機能も明らかとした。IL-1β前駆体を切断して成熟型IL-1βを産生する酵素として、好中球由来のプロテイナーゼ3(proteinase 3)やエラスターゼ(elastase)が知られていることから(6)、我々の結果を総合的に考えると、NLRP3が欠損すると虚血再灌流肝への好中球の遊走と浸潤が抑制されるため、好中球からのIL-1β前駆体の切断酵素も減少することでIL-1βの産生が減少し、その後の炎症反応と肝障害が軽減すると考えられた。
おわりに
本研究では、これまでに知られていなかったインフラマソームとは独立したNLRP3の新たな機能を明らかとしたとともに、好中球が関与する疾患におけるNLRP3の治療標的としての可能性が示された。
参考文献
1. Jaeschke H. Mechanisms of Liver Injury. II. Mechanisms of neutrophil-induced
liver cell injury during hepatic ischemia-reperfusion and other acute inflammatory
conditions. American journal of physiology Gastrointestinal and liver physiology.
2006;290(6):G1083-8.
2. Martinez-Mier G, Toledo-Pereyra LH, McDuffie JE, Warner RL, Ward PA.
Neutrophil depletion and chemokine response after liver ischemia and reperfusion.
Journal of investigative surgery : the official journal of the Academy of Surgical
Research. 2001;14(2):99-107.
3. Davis BK, Wen H, Ting JP. The inflammasome NLRs in immunity, inflammation,
and associated diseases. Annual review of immunology. 2011;29:707-35.
4. Takahashi M. Role of the inflammasome in myocardial infarction. Trends in
cardiovascular medicine. 2011;21(2):37-41.
5. Kawaguchi M, Takahashi M, Hata T, Kashima Y, Usui F, Morimoto H, et al.
Inflammasome activation of cardiac fibroblasts is essential for myocardial
ischemia/reperfusion injury. Circulation. 2011;123(6):594-604.
6. Coeshott C, Ohnemus C, Pilyavskaya A, Ross S, Wieczorek M, Kroona H, et al.
Converting enzyme-independent release of tumor necrosis factor alpha and
IL-1beta from a stimulated human monocytic cell line in the presence of activated
neutrophils or purified proteinase 3. Proceedings of the National Academy of
Sciences of the United States of America. 1999;96(11):6261-6.